
Le jeûneN1 est un sujet sensible, étant données les conotations religieuses, mystiques, culturelles et politiques de cette pratique…
La question que je souhaite aborder ici est la place de la restriction calorique (en général) en termes de longévité et de maintien de la santé.
Sommaire
⇪ Mon expérience

J’ai découvert le jeûne dans le contexte de l’action non-violente d’inspiration gandhienne (années 1960–70). La dénonciation de la torture en Algérie, l’opposition à l’extension du camp militaire au Larzac, la mobilisation pour la création d’un statut d’objecteur de conscience et, localement, la réhabilitation de personnes logées en bidonville, ont été l’occasion d’inscrire cette pratique comme une forme d’action politique reconnue du public. On parlait de jeûnes protestataires ou grèves de la faimN2 pour effacer toute connotation religieuse. Ces grèves étaient souvent individuelles, notamment en milieu carcéral, parfois prolongées jusqu’au décès des protestataires.

Personne n’ignore — mis à part les respirianistesN4 qui prétendent se nourrir de prāna ou de lumière ! (voir N5·N6·N7 et N8) — que s’abstenir de toute nourriture solide conduit à la mort après quelques semaines. La durée du sursis varie fortement selon les individus.
Les jeûnes collectifs de ces années étaient pour la plupart limités à une dizaine de jours. En veillant à une hydratation suffisante, ils produisaient souvent un effet salutaire sur la santé des militants, d’autant plus ceux qui avaient une tendance au surpoids. C’est ainsi que j’avais adopté une pratique régulière du jeûne avec pour objectif principal de ne plus prendre de poids et d’épurer mon organisme — on parle aujourd’hui de « détoxiner »N9. Selon les époques, je faisais une semaine de jeûne au printemps ou à la fin de l’été, ou encore une journée par semaine, plus romantiquement trois jours à la pleine lune…
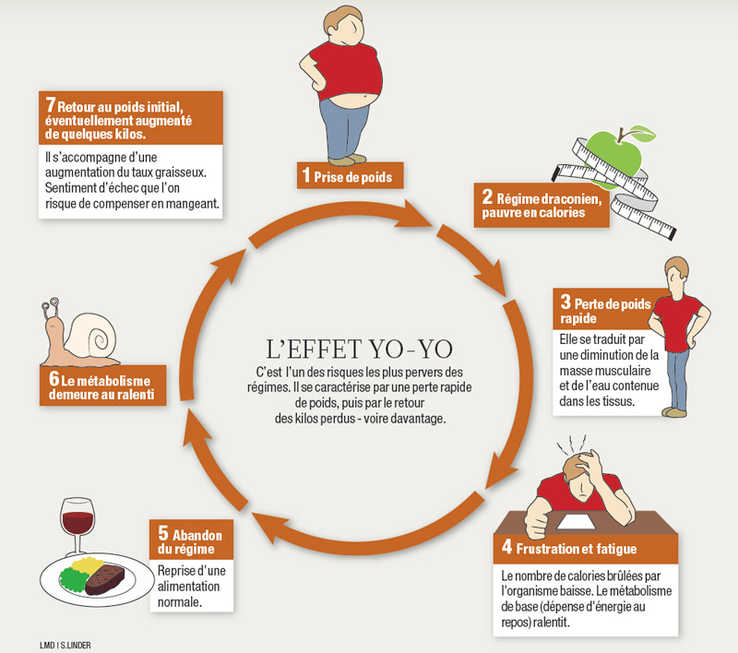
L’effet de régulation du poids, remarquable les premières années, s’est rapidement estompé. Pour compenser une prise de poids (environ 1 kilo par an) qui me paraissait inéluctable, malgré l’adoption d’une alimentation presque exclusivement végétarienne exempte de produits industriels, j’ai effectué de nombreuses tentatives de jeûne hydrique intégral sur une durée jusqu’à 3 ou 4 semaines. Ceci pour constater qu’elles résultaient toujours en une perte de poids insignifiante avec une reprise dans les mois suivants qui aggravait mon cas. C’est l’effet yo-yoN10 bien connu de tout régime privatif (Gutierrez N, 2023N11 ; Grzelka K et al., 2023N12). ?
Quelle que soit la durée du jeûne, je le vivais dans un état d’euphorie qui peut expliquer un engouement pour cette pratique. J’y voyais la réponse à un besoin de détoxicationN14 en dépit des témoignages de personnes chez qui cette « purification » se traduisait plutôt par des maux de tête. Je ne me suis jamais posé la question d’un réel besoin de nettoyage alors que ma nourriture était réputée saine et l’environnement des plus favorables — voir mon article Détoxination.
Pendant ces longues périodes de jeûne, je n’éprouvais aucune faiblesse dans l’exécution du travail quotidien ni d’efforts physiques. Il est vrai que j’avais de plus en plus de réserves !
Cette expérience m’a convaincu que le jeûne (de plus d’une journée) n’avait aucun effet, pour ce qui me concerne, sur la régulation du poids. Aucune étude scientifique concluant aux bienfaits du jeûne thérapeutique ne mentionne la guérison de l’obésité parmi les bénéfices escomptés. Je me suis libéré de l’obésité, bien plus tard, en modifiant radicalement mes habitudes alimentaires — voir mon article chrononutrition - expérience. En l’absence de pathologie, elle peut être vaincue — pour la majorité des personnes mais pas toutes — avec un meilleur équilibre nutritionnel réduisant la part des glucides au bénéfice des « bonnes graisses ». Voir à ce sujet mes articles Glucides ou lipides ? et Diète cétogène - expérience. J’aborderai plus tard l’importance de la santé des microbiotes dont j’ai commencé à faire l’expérience fin 2022.
Une version contestée de la promotion du jeûne thérapeutique consiste à préconiser une restriction calorique de longue durée comme remède à l’insulinorésistanceN15 ; voir à ce sujet le commentaire véhémentN16 de Jane Plain à propos des efforts désespérés de Jimmy Moore et des préconisations controversées de Jason FungN17. L’expérimentation de disette réalisée par Ancel Keys aux USA en 1944–1945 (Minnesota Starvation ExperimentN18) au cours de laquelle 36 hommes volontaires ont été soumis pendant six mois à un régime d’environ 1500 kcal/jour, a montré que cette situation induisait de la détresse, de la dépression et de l’hystérie, avec une baisse significative de la libido et une obsession de la nourriture. Ces effets sont en tous points analogues à ceux de l’anorexie nerveuseN19.
D’autres expériences personnelles aboutissent à des résultats différents.
⇪ Effets mesurables

Source : N20
Un documentaire Le jeûne, une nouvelle thérapie ? a été diffusé par ARTE le 6 mars 2011, donnant lieu à de nombreux commentaires (voir N21). Il débute par la présentation de plusieurs décennies d’expérience du jeûne thérapeutique en Russie, notamment au sanatorium de Goriachinsk dans la plaine sibérienne. Ces travaux ont été documentés en russe sans être traduits ni publiés dans des revues médicales. La suite du reportage présente la clinique BuchingerN22 sur les rives du lac de Constance en Allemagne, où l’on soigne par le jeûne des maladies chroniques. Les déclarations des soignants s’appuient sur des travaux menés aux USA, principalement en expérimentation animale.
Il est intéressant de signaler que ce reportage est souvent cité à l’appui de l’affirmation : « Le jeûne guérit le cancer ». En réalité, la présentation des travaux de l’équipe de Valter D LongoN23 cités à plusieurs reprises dans le reportage (exempleN24) annonce que le jeûne ne guérit pas le cancer mais peut retarder la croissance des tumeurs et améliorer les effets de la chimiothérapie. Il s’agissait d’ailleurs plutôt de short-term starvation, autrement dit une restriction calorique/protéinique de durée n’excédant pas 24 heures — voir mon article Cancer - approche métabolique. Dans une autre étude (Cheng CW et al., 2014N25) l’équipe a montré qu’un jeûne prolongé (3 jours) pourrait aussi entraîner un renouvellement de cellules souches qui contrecarrerait l’immunosuppressionN26 provoquée par la chimiothérapie — voir FMD ci-dessous.
Dans la littérature scientifique, le cancer est cité comme une contre-indication à la pratique du jeûne thérapeutique. Pour plus de détails, voir mon article Cancer - sources.
Dix ans plus tard, la même équipe d’ARTE (Sylvie Gilman et Thierry de Lestrade) a réalisé un nouveau documentaire : Le jeûne, enquête sur un phénomène (2025N27). Ce film a été, une fois de plus, acclamé par le public et la presse francophone… Une lecture sans complaisance de ce discours et des « oublis » de la démonstration est proposée par Jérémy Anso (2025N28).
En ce qui concerne les cures en clinique de jeûne, il n’est pas surprenant qu’elles ne fassent l’objet d’aucune publication scientifique. Pour commencer, on n’y a pas conduit des essais randomisés contrôlésN29 : la clientèle de ces cliniques est volontaire ; on n’étudie pas un échantillon représentatif de la population qui serait réparti par tirage au sort dans plusieurs groupes, dont un qui bénéficierait pleinement du traitement (jeûne, exercice physique, coaching psychologique, environnement) et les autres pour qui le jeûne serait remplacé par une nutrition équilibrée sans restriction calorique, ou même qui continueraient à s’alimenter selon leurs habitudes tout en participant aux autres activités proposées.
L’absence de choix d’un échantillon de population introduit un biais considérable. Les clients (assez fortunés) de ces cliniques sont en majorité des personnes qui souffrent de maladies chroniques plus ou moins graves, souvent en surpoids, résultat d’une mauvaise hygiène alimentaire. Il est clair qu’un séjour de quelques semaines dans un environnement accueillant avec promenades en forêt, exercice encadré par des entraîneurs, psychothérapie et absence de malbouffe, ne pouvait qu’améliorer leur état, y compris pour la rémission temporaire de symptômes graves. Leur santé continue à s’améliorer si, une fois rentrés chez eux, les patients gardent les bonnes habitudes acquises durant leur séjour en clinique. Mais tout cela pourrait n’avoir rien à voir avec la pratique du jeûne. Une pratique nutritionnelle équilibrée et l’élimination de toute addiction auraient peut-être de meilleurs effets sur le long terme.
Plus précisément, sachant qu’un grand nombre de maladies chroniques, douleurs articulaires, ou même maladies auto-immunes, sont liées à de l’inflammation, et qu’une des causes de cette inflammation se trouve dans la nutrition, il est logique que les symptômes s’atténuent ou disparaissent pendant une longue période de jeûne hydrique. L’efficacité du jeûne est dans ce cas le signal de mauvais choix nutritionnels : le plus souvent, aujourd’hui, la croyance qu’un régime principalement végétal devrait réduire l’inflammation alors que c’est l’inverse qui se produit. Lire mon article à ce sujet.
C Lee et Valter D Longo (2011N30) écrivent :
La réponse physiologique au jeûne est tout à fait différente de celle à un régime sous-calorique. Chez les mammifères, il y a trois étapes métaboliques pendant la privation de nourriture (Wang et al., 2006N31). Tout d’abord, la phase postabsorbtive, qui peut durer au moins 10 heures après l’ingestion de nourriture et implique l’utilisation du glycogèneN32 en tant que source principale d’énergie stockée. Lorsque le stock de glycogène dans le foie a été épuisé, elle est suivie par la seconde phase dans laquelle des acides aminés servent de substrat pour la néoglucogenèseN33.
Finalement, les acides gras et le glycérolN34 libérés par les tissus adipeux deviennent la principale source d’énergie. Le glucose résiduel est surtout consommé par le cerveau, et les corps cétoniquesN35 nouvellement dérivés des graisses (acétoacétate, β‑hydroxybutyrate et acétone) deviennent en quelques jours des sources de carbone majeures (Cahill, 1970N36 ; Cahill et al., 1970N37 ; Cahill, 2006N38).
Ils précisent (ibid.) :
Suite à un jeûne prolongé durant une semaine ou plus, le β‑hydroxybutyrate dérivé de graisses devient le corps cétoniqueN35 le plus abondant, ce qui représente environ les deux tiers du carburant du cerveau, et la production de glucose atteint un niveau très modeste (Cahill, 2006N38). Au cours de la dernière phase de jeûne prolongé, les réserves de graisse sont épuisées et une dégradation musculaire rapide se produit pour alimenter la néoglucogenèseN33. […]
On estime qu’une personne de 70 kg peut couvrir ses besoins caloriques de base avec les réserves de graisse pendant jusqu’à 2–3 mois de jeûne (Cahill GF & Owen OE, 1968N39 ; Cahill GF et al., 1968N40 ; Saudek CD & Felig P, 1976N41). Ainsi, un jeûne prolongé est faisable et généralement bien toléré chez les humains, mais peut être accompagné par des effets secondaires relativement mineurs, tels que maux de tête, des étourdissements, des nausées, de la faiblesse, de l’œdème, de l’anémie et de l’aménorrhée (Bloom WL, 1959N42 ; Drenick EJ et al., 1964N43 ; Thomson TJ et al., 1966N44). Dans certains rares cas, on a signalé qu’un jeûne extrême pour des périodes de plusieurs semaines ou plus chez des sujets obèses avait entraîné des complications mortelles comme l’insuffisance rénale, l’insuffisance cardiaque et l’acidose lactique (Cubberley PT et al, 1965N45 ; Spencer IOB, 1968N46 ; Garnett ES et al., 1969N47 ; Runcie J & Thomson TJ, 1970N48). […] En outre, la pratique du jeûne devrait être réservée à des sujets qui ne présentent pas d’irrégularités dans les voies métaboliques.
Pratiquer un jeûne de longue durée (typiquement plus de cinq jours) sans surveillance médicale comporte de sérieux risques. Par exemple, chez une personne diabétique (de type 1 ou de type 2 dans une phase avancée) ou sujette à un alcoolisme chronique, le pancréas est incapable de sécréter suffisamment d’insuline pour limiter la production de corps cétoniquesN35. Cette insuffisance peut se traduire par une acidocétoseN49 qui peut être fatale.
La question de la fonte musculaire fait l’objet de débat. Chez une personne qui n’a pas d’abondantes réserves de graisse elle peut démarrer beaucoup plus tôt que la semaine évoquée par Lee et Longo (voir ci-dessus). Il est probable que tout jeûne hydrique dépassant 48 heures se traduise par une perte de muscle — remplacé par de la graisse après la reprise alimentaire. On peut aisément observer cette obésité sarcopéniqueN50 chez les fanatiques de « détox »…
Certains auteurs vont jusqu’à recommander le jeûne sec (sans hydratation) pour « éliminer le gras plus vite que le muscle ». Selon Gudinez B (2018N51), un organisme en état de cétoseN52 pourrait fabriquer de l’eau en interne à partir du gras. Mais elle ajoute que ce mécanisme n’est efficace qu’après une alimentation riche en graisses. Par conséquent, les graisses brûlées sont celles des aliments et non la graisse corporelle. De plus, cette oxydation génère, non pas des cétones comme souhaité, mais du gaz carbonique et de l’eau (Stookey JD, 1999N53). Cette approche est donc très risquée et certainement à proscrire au-delà de 24 heures ! Les respirianistesN4 en ont popularisé une version suicidaire avec leur Processus des 21 joursN54…

Plus généralement, tout jeûne induit un mécanisme d’autophagieN56 bénéfique au démarrage — destruction de composants cellulaires endommagés — mais qui peut assez vite devenir symptomatique (Dinkov G & P Saladino, 2023N57 50:30), par un effondrement de la masse musculaire — en s’apparentant à un auto-cannibalisme des ressources de l’organisme. Leonoor, leader du groupe sectaire Contact & MuziekN55 (photo ci-contre) écrivait :
Si vous découvrez que la nutrition n’est en fait pas du tout nécessaire, tout changera et tout sera différent, mais aussi de plus en plus familier. Nous ressentons beaucoup plus de contact avec notre corps, manger nous fatigue, c’est notre expérience, digérer la nourriture est un travail difficile. […] Nous avons besoin de gens qui montrent que c’est possible, très bien. Dans le monde entier, il y a de plus en plus de personnes qui y travaillent, des sources lumineuses, vivant de la lumière, des respirianistes. […]
En fait vous n’avez pas besoin de nourriture. Des bébés et des enfants meurent des suites de vaccinations, les parents sont même accusés de maltraitance, laissés dans une confusion totale et n’ont pas la possibilité de reconnaître leur tristesse, leur colère et leur perplexité.
Certaines personnes réagissent mal au jeûne, ce qui se traduit par un taux élevé d’hormone de stress (cortisolN58). Dans un entretien filmé (2023N57 40:51–44:28), Georgi Dinkov cite des travaux montrant qu’aucun patient atteint d’un cancer n’avait un rapport cortisol sur DHEAN59 inférieur à 1.5. Celui-ci ne devrait pas dépasser 0.5 — en début d’après-midi, pas à jeun… Dinkov précise :
Ces élévations chroniques de cortisol, qui se produisent lors d’un jeûne, ne sont bonnes pour personne, mais une personne jeune et en bonne santé est probablement mieux placée pour y faire face et bénéficier de la réduction des endotoxines. Mais si vous êtes plus âgé… c’est peut-être la pire chose à faire.
Les personnes âgées sont connues pour se fragiliser très rapidement si elles sautent, ne serait-ce qu’un seul repas. Elles ne mangent pas très souvent, mais elles ont besoin de leur repas. Si vous ne le leur donnez pas, elles peuvent très vite décliner.
En fonction de la personne, le jeûne peut donc ne pas produire les effets bénéfiques escomptés, et bon nombre de ces effets bénéfiques peuvent être imités en prenant du charbon de bois, en réduisant les amidons résistants, et en consommant davantage d’hydrates de carbone simples, tels que le miel et les jus de fruits. Ces mesures permettraient probablement d’obtenir les mêmes résultats, en termes de rapport entre le cortisol et la DHEAN59 […] et la plupart des gens peuvent le faire. […]
En réalité, le jeûne permet de réduire l’inflammation due aux endotoxines. Prenez donc du charbon végétal […] et mangez-en une cuillère à soupe par jour. C’est probablement plus que suffisant. Vous n’avez pas besoin de vous torturer.
Invariablement, les personnes qui bénéficient le plus du jeûne ont tendance à être plus jeunes, plus minces et en meilleure santé. Les personnes en surpoids ou plus âgées, c’est-à-dire celles qui ont plus de 50 ans, ne supportent pas bien le jeûne. Une étude a montré que les personnes de plus de 50 ans qui pratiquaient le jeûne de façon chronique couraient, une fois le jeûne terminé, un risque beaucoup plus élevé de contracter une infection potentiellement mortelle, probablement en raison du cortisol qui est immunosuppresseur.
Il faut enfin signaler que la pratique du jeûne thérapeutique est un facteur de perturbation des cycles chronobiologiques. Édouard Courot écrit à ce sujet (2016N60 pages 78 et 80) :
[…] On peut supposer que la sécrétion cyclique de certaines enzymes digestives gastro- intestinales, ainsi que de nombreux métabolites ayant un rôle dans le métabolisme, se font à des heures précises en prévision d’un apport alimentaire afin d’optimiser la digestion et l’utilisation des nutriments.
Par conséquent, des repas pris à heures régulières renforcent les oscillations de ces rythmes et sont un facteur de protection vis‑à-vis de troubles métaboliques. […]
De façon générale, sauter un repas perturbe la synchronisation des horloges périphériques. Pour faire l’analogie avec l’horloge centrale, c’est un peu comme si un individu se maintenait exposé à la lumière pendant 24h en sautant une nuit : l’horloge centrale en serait perturbée.
La thèse de médecine de Jérôme Lemar (2011N61) comportait une revue bibliographique de publications sur les effets thérapeutiques du jeûne en expérimentation humaine et animale. L’auteur commence par situer le jeûne dans une vision d’ensemble hors du contexte médical. Il en décrit ensuite le mécanisme métabolique, puis il aborde les « diètes » dans le cadre de la médecine conventionnelle. La suite de la thèse s’intéresse au jeûne en tant que pratique amaigrissante ainsi qu’aux jeûnes prolongés « thérapeutiques » dans le cadre des médecines non-conventionnelles. L’auteur termine par des données sur l’alternate-day fasting (voir ci-dessous) et une étude critique de la détoxification — voir mon article Détoxination. Pour ce qui est du jeûne thérapeutique en général, il conclut (pages 122 et 125) :
La lecture critique de ces articles a donné des résultats parfois intéressants, souvent contrastés et de faible niveau de preuve à court-terme, et des résultats majoritairement manquants à long-terme. Dans ces études, certains biais ont paru évitables et justiciables d’une évaluation plus rigoureuse. D’autres difficultés méthodologiques questionnent sur la potentialité d’obtenir des preuves factuelles solides lorsque le jeûne est évalué en intention de traiter [N62]. Enfin, les bénéfices réels liés à ces pratiques sont restés à l’image de leurs mécanismes d’action, inconnus, imprécis et hypothétiques. […]
L’étude des bienfaits supposés du jeûne thérapeutique ne répond pas aux exigences actuelles de la médecine factuelleN63. Les études sont en majorité de type « série de cas », de qualité moyenne ou faible, rarement contrôlées, certaines étant de faible niveau de preuve, voire littéralement ininterprétables en termes statistiques. Leurs évaluations à long terme sont soit manquantes soit imprécises. Sans compter les innombrables indications pressenties n’ayant pas, à notre connaissance, fait l’objet d’une évaluation de type essai clinique, l’analyse des quelques indications ayant pu être plus ou moins approfondies dans ce travail oscille entre discours de réserve, de prudence, de perplexité, voire de rejet.
L’important pour tous les régimes est que les améliorations continuent après la période de traitement, ce qui est rarement le cas du jeûne hydrique de longue durée dont les bienfaits sont souvent annihilés par effet yo-yoN10 (Gutierrez N, 2023N11).
⇪ Régime simulant le jeûne (FMD)
Une pratique de restriction calorique sur des périodes de cinq jours est décrite par Valter D Longo sous le nom de régime simulant le jeûne (Fasting Mimicking Diet®, FMDN64). Elle est présentée en détail dans son ouvrage The Longevity Diet (2018N65, ou Le Régime de longévitéN66 en français) — dans lequel j’ai relevé un bon nombre d’incohérences et de falsifications, voir mon article Régime de longévité - cuisine à l'italienne.
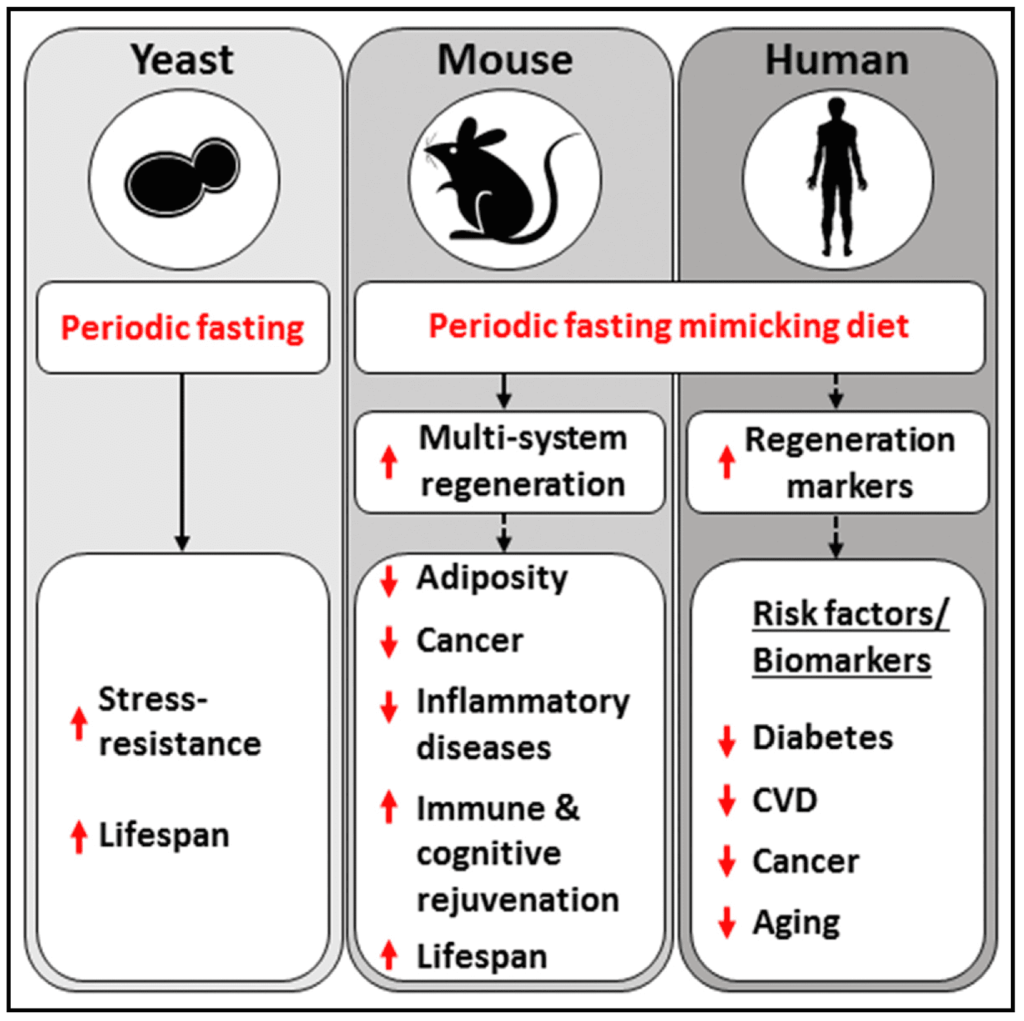
L’étude A Periodic Diet that Mimics Fasting Promotes Multi-System Regeneration, Enhanced Cognitive Performance, and Healthspan, menée sur des humains et des souris par Sebastian Brandhorst, Valter D Longo et al. (2015N67), a mesuré les effets de ces périodes de 5 jours, durant lesquels les sujets se contentaient d’un régime à base de plantes hypocalorique, bien que dense en macronutriments, faible en glucides et protéines, mais riche en graisses.
Le régime FMD propose 1090 calories le premier jour et 725 chacun des 4 jours suivants (voir l’article de presseN68). Les proportions caloriques des macronutriments sont 45 % de glucides, 45 % de graisses et 10 % de protéines. Il est fait d’un mélange d’aliments végétaux, d’électrolytes et de compléments vitaminés, commercialisé (aux USA pour 249 dollars) dans le kit ProLonN64.
Brandhorst et collègues (2015N67) ont observé que, pendant les périodes de demi-jeûne FMD, l’organisme puise dans ses réserves de glucose, de graisses et de cétonesN69, mais il élimine aussi une fraction de ses globules blancs. Selon les auteurs, cette raréfaction des globules sanguins amorcerait un processus conduisant à la régénération de cellules immunitaires grâce à la production de cellules souchesN70. Entre autres, une réduction de la protéine kinase A (PKAN71) que l’équipe avait précédemment associée à une augmentation de longévité. On sait par d’autres travaux qu’elle régule le renouvellement des cellules souches et leur pluripotenceN72 — la faculté de se différencier en plusieurs types de cellules.
L’expérience animale suggère que la pratique du FMD serait plus efficace que le jeûne hydrique intégral en termes de « réparation de l’organisme ». Le régime simulant le jeûne peut être pratiqué périodiquement selon les besoins ressentis : d’une fois par mois à deux ou trois fois par an. Valter Longo et ses collègues (2016N73) affirment qu’il serait plus bénéfique pour la santé et la longévité que le jeûne fractionné (en anglais intermittent fasting) décrit ci-dessous, mais cette comparaison fait débat. Les « preuves » restent anecdotiques, voire appuyées sur une expérimentation animale qui n’est pas extrapolable aux humains…
⇪ Pratique du demi-jeûne fractionné
Le demi-jeûne fractionné est une technique de mise en forme, sans prétention miraculeuse malgré ses effets bénéfiques observés et documentés. On parle de demi-jeûne pour désigner une restriction calorique qui peut aller du quart de la ration habituelle à la suppression de toute nourriture solide. Cela pour une durée limitée, de quelques heures à 48 heures. En médecine, on considère que l’organisme est « à jeun » après 6 heures sans nourriture.
Le fractionnement peut prendre de multiples formes. Il est défini succinctement sur la page jeûne intermittentN74 de Wikipedia. Voici cinq options décrites sur un article (lien cassé) consacré au traitement de l’obésité :
- Leangains — Jeûner de 14 à 16 heures et se nourrir les 8 à 10 heures restantes dans la journée. Il est souvent suggéré de jeûner ainsi la nuit et de rompre le jeûne 6 heures après le réveil.
- Eat Stop Eat — Jeûner intégralement pendant 24 heures une ou deux fois par semaine.
- The Warrior Diet — Consiste à jeûner chaque jour pendant 20 heures et à se nourrir uniquement d’un repas copieux chaque nuit. Pendant le jeûne, si on le désire, on peut consommer des fruits ou légumes crus, ainsi que des sources de protéines. Les promoteurs justifient ce régime en affirmant qu’il serait en accord avec le cycle circadien car notre espèce aurait été programmée pour se nourrir la nuit — ce qui est contredit par la chronobiologie…
- Fat Loss Forever — Une combinaison des méthodes précédentes : on décide d’une journée joker par semaine (sans restriction) suivie d’un jeûne de 36 heures. Le reste de la semaine, on choisit parmi les autres protocoles ceux qui s’accordent le mieux avec son activité et ses contraintes socio-professionnelles.
- UpDayDownDay™ — Un jour avec forte restriction calorique (par exemple 400 kcal) et le suivant sans restriction (par exemple 2000 kcal).
Sur le site de Joseph Mercola, deux méthodes analogues à celles-ci ont été décrites et commentées. Ainsi, Dr Krista VaradyN75 recommandait The Other Day DietN76, une réduction calorique tous les deux jours (5e option ci-dessus) qui a inspiré le Stop & go de Taty Lauwers (voir ci-dessous).

Michael Mosley fait la promotion du régime 5:2N78 dans lequel on mange normalement 5 jours par semaine et on se limite pendant 2 jours au quart du besoin calorique. Les deux jours de diète ne sont pas consécutifs, à chacun de décider comment les répartir. L’ouvrage de Kate Harrison (2015N77) — recommandé par Taty Lauwers — décrit bien cette pratique.
➡ Des variantes du demi-jeûne fractionné, par exemple 4 jours de réduction calorique et pas de restriction les 3 jours suivants, sont vendues au prix fort sur les sites qui prétendent guérir l’obésité « sans régime ni exercice ni médicaments » (Mike Whitfield par exempleN79). Ces sites utilisent des ‘upsell templates’N80 conçues par des spécialistes de la vente forcée qui exploitent la naïveté des consommateurs et font du ‘buzz’ à l’aide de publi-reportages bien positionnés sur les moteurs de recherche — voir mon article
“Health coaching” : business models en roue libre.
La pratique du demi-jeûne quotidien (méthode 1 ci-dessus) est à première vue plus évidente que celle de jeuner en alternance. On peut en effet penser qu’il serait difficile de ne pas compenser une période de restriction par de la surconsommation, mais des retours d’expérience sur l’UpDayDownDay ne confirment pas cette crainte. La périodicité de la restriction calorique permet dans tous les cas de réduire l’insulinorésistanceN15 et de réguler la ghrélineN81, une hormone digestive qui stimule l’appétit.
Le choix entre une pratique périodique quotidienne ou hebdomadaire de restriction calorique est conditionné par l’augmentation de l’hormone de stress (cortisolN58) qui peut être dérangeante si elle se produit chaque jour. Une fois que la pratique de restriction calorique a restauré la sensibilité à l’insuline — autrement dit la « flexibilité métabolique » — il est préférable d’augmenter la fenêtre alimentaire. En effet, si l’on prive l’organisme de glucose pendant trop longtemps, il produit du cortisol pour stimuler la production de glucose par le foie. Cette augmentation du cortisol peut contribuer à l’inflammation chronique et aux dommages cellulaires, et donc paradoxalement se traduire par une prise de poids (voir pageN82)…
Dans son ouvrage Au-delà des régimes (2019N83 p. 13–18), Taty Lauwers distingue quatre catégories de pratiquants de régimes amincissants, dont les deux premières — les bleus et les touche-à-tout des régimes — n’ont pas encore développé une résistance physiologique à la privation, et les dernières — vétérans et madones — chez qui un régime restrictif peut produire un effet yo-yo, autrement dit leur poids ne varie plus quelles que soient leurs habitudes nutritionnelles et sportives.
L’auteure se situait dans cette dernière catégorie, après de nombreux essais infructueux de régimes alimentaires, entre autres ceux faibles en glucides (low-carb high-fat), la chrono-nutrition®, la paléonutrition et le jeûne intermittent. Elle a mis en pratique une « issue de secours » qu’elle appelle le mode Stop & go (N83 pages 67–105). On peut classer cette méthode dans le type 5 (UpDayDownDay™, voir ci-dessus) car c’est une déclinaison de The Other Day Diet enseigné par Krista VaradyN76 : alterner un jour « gras » (sans restriction) et un jour « maigre » où l’on consomme seulement le quart du contenu calorique habituel, typiquement 500 kcal en moyenne.
La restriction porte principalement sur les glucides et les lipides, aliments les plus riches en calories. Le choix des aliments pendant les jours maigres et gras reste individuel. Il n’y a aucune contrainte sur les proportions respectives de glucides et lipides, ni sur une limite à respecter les jours « gras ». La régulation de l’appétit se fait d’elle-même une fois que l’organisme a retrouvé son métabolisme normal.
Dans une étude clinique en 2017, Krista Varady a montré que The Other Day Diet permettait de perdre 3 à 8 % de son poids en trois à douze moisN84. Une diminution lente du surpoids est préférable et plus durable. D’autre part, la progression se mesure plutôt au tour de taille qui permet d’estimer la quantité de graisse viscérale.
La périodicité du Stop & go respecte les rythmes chronobiologiques en instaurant une alternance régulière (de période courte) entre une nutrition à satiété et une phase de « nettoyage » de l’organisme. Cette forme de jeûne intermittent se distingue donc des régimes simulant le jeûne (voir plus haut) qui imposent la restriction pendant cinq jours, au risque de désynchroniser les horloges périphériques circadiennesN85 — voir N86 et N73.
Le cycle de 48 heures du Stop & go s’installe facilement lorsque l’organisme ressent le bénéfice d’une alternance entre « jours de fête » et « jours de repos ». Cela suppose qu’on ait déjà une vie bien réglée en termes de cycles de sommeil et de nourriture : on peut alors se fier aux sensations pour décider du contenu, des quantités et heures des repas. La solution optimale est différente pour chaque individu et peut évoluer dans le temps. Celle qui me convient le mieux est de ne consommer qu’un petit-déjeuner léger (mais « chrono » avec fromage/beurre/œuf) le jour de « repos » et d’enchaîner sur un jeûne hydrique qui dure donc presque 24 heures. Le « jour de fête », juste avant la rupture de jeûne, une séance d’exercice de haute intensité multiplie les effets du jeûne — voir plus bas au paragraphe « Exercice ».
Cette pratique restaure en partie la sensation de satiété — sensibilité à la leptineN87 ? — car on ne tend pas à compenser la restriction calorique en se suralimentant le jour suivant. Il est donc attendu qu’une personne dont le surpoids serait causé principalement par un excès de nourriture puisse en bénéficier pour réguler son appétit.
Toutefois, la régulation de l’appétit dépend fortement de la nature des aliments consommés. Dans mon cas, le retour de la satiété était bloqué par la consommation devenue trop récurrente de yaourts (nature/bio/lait de brebis ou de chèvre) — effraction à ma pratique bénéfique de chrononutrition ! Ces laitages n’apportent rien d’utile si l’on consomme déjà une grande variété de fromages affinés au lait cru ; par contre, comme tout aliment fermenté, ils sont susceptibles de modifier le microbiote intestinalN88 avec pour effet une stimulation de l’appétit. Un autre raison est que le lactosérumN89 (petit-lait) augmente la résistance à l’insulineN15 : plus d’insuline diminue la glycémie et peut provoquer des fringales (Adams RL & KS Broughton, 2016N90). Ce mécanisme est décrit par Michael Eades dans The Arrow #200. J’avais fait l’erreur de croire que les seuls yaourts concernés étaient ceux enrichis au « bifidus » et autres substances magiques…
Source : Mirandole (2018N91)
Supprimer tous les yaourts a vite restauré chez moi un mécanisme plus net de satiété, au point que les périodes de restriction calorique se sont installées spontanément, sans schéma préétabli, et ne sont pas vécues comme de la « restriction ». Cette impression de naturel me paraît en phase avec ce que décrit Paul Saladino (2020N92 page 161) :
[Les] deux processus opposés de dégradation et de croissance des cellules sont respectivement appelés catabolismeN93 et anabolismeN94, et tous deux jouent un rôle vital tout au long de notre vie, car notre corps oscille entre des périodes de construction et de recyclage des composants cellulaires tout au long de la journée.
⇪ Les effets de la restriction calorique/protéinique
À l’inverse du jeûne hydrique de longue durée, le demi-jeûne fractionné (intermittent semi-fasting) et le régime simulant le jeûne (FMD) ont fait l’objet de travaux en expérimentation animale et humaine qui mesuraient leur efficacité, entre autres l’étude de Valter D Longo et Mark P Mattson (2014N95). Cette efficacité se situe dans le maintien en bonne santé, garantie de longévité dont l’élimination du surpoids n’est qu’un aspect. Voici une liste non-exhaustive des mécanismes observés :
- AutophagieN96 — qui permet une plus grande résistance à la maladie et au vieillissement, avec des réserves chez les personnes souffrant de cancer (Anso J, 2023N97)
- Production d’hormone de croissance humaine (Human Growth Hormone, HGHN98)
- Augmentation de l’hormone appelée facteur neurotrophique issu du cerveau (brain-derived neurotrophic factor, BDNFN99) qui protège contre des affections neurologiques comme les maladies d’Alzheimer et de Parkinson
- (Prouvé sur des rongeurs) protection contre le diabète de type 2N100, le cancer et les maladies cardiovasculaires. L’ouvrage de Jason Fung, The Complete Guide to FastingN101 affirme l’efficacité du jeûne thérapeutique pour un traitement complet, chez les humains, du diabète de type 2N100 : des patients initiés à cette pratique pendant moins de 3 semaines ont fini par se passer totalement de médicaments.
L’étude de Varady KA (2011N102) sur le traitement de l’obésité montre que les pratiques de restriction calorique quotidienne et fractionnée donnent des résultats comparables en termes de perte de masse graisseuse après 3 à 12 semaines, mais que la restriction fractionnée serait plus efficace pour la conservation de la masse maigreN103, autrement dit de la masse musculaire et osseuse.
La restriction calorique/protéinique cyclique, enfin, permettrait de ralentir le vieillissement. L’expérimentation animale montre un accroissement de l’espérance de vie moyenne, mais aussi de l’espérance de vie maximale, lié à une privation régulière de nourriture et à des conditions d’existence difficiles (mécanisme d’hormèseN104). Ces résultats sont commentés sur la page Caloric Restriction, Hormesis, and what they teach us about Evolution (Mitteldorf J, 2015N105) — voir une traduction approximativeN106. On peut aussi consulter le site de Calorie Restriction SocietyN107.
Jason Fung (2018N108) énumère les niveaux d’observation qui servent à caractériser des pathologies, regrettant qu’on ait trop longtemps négligé celui des mitochondriesN109 intermédiaire entre ceux de la cellule et du matériel génétique — « comme si ces organites [N110] ne devaient jamais tomber malades »… Il ajoute :
Une attention croissante est accordée à la dysfonction mitochondriale qui contribue à de nombreuses maladies parce que ces organites se trouvent à la croisée de la détection et de l’intégration des signaux de l’environnement pour déclencher des réponses cellulaires adaptatives et compensatoires. Autrement dit, [les mitochondries] jouent un rôle clé dans la détection de l’environnement extérieur et l’optimisation de la réponse appropriée de la cellule. La maladie mitochondriale [N111] semble être liée à plusieurs des maladies de croissance excessive, y compris la maladie d’Alzheimer et le cancer. Cela fait sens parce que les mitochondries sont les producteurs d’énergie de la cellule.
L’étude de Weir J et al. (2017N112) constitue une étape vers l’explication des mécanismes biologiques qui sous-tendent l’augmentation de l’espérance de vie associée au demi-jeûne fractionné. En effet, l’équipe a démontré un lien causal entre les modifications dynamiques de la configuration des réseaux de mitochondriesN109 et la longévité. La Harvard Gazette préciseN113 :
Les scientifiques ont utilisé C. elegans (vers nématodesN114) qui ne vivent que deux semaines et permettent ainsi l’étude du vieillissement en temps réel en laboratoire. Les réseaux mitochondriaux à l’intérieur des cellules basculent généralement entre les états fusionnés et fragmentés. Les chercheurs ont découvert que restreindre le régime alimentaire des vers, ou imiter la restriction alimentaire par manipulation génétique d’une protéine sensible à l’énergie appelée AMPK (AMP-activated protein kinaseN115), maintenait les réseaux mitochondriaux dans un état fusionné ou « juvénile ». En outre, ils ont constaté que ces réseaux juvéniles augmentaient la durée de vie en communiquant avec des organitesN110 appelés peroxysomesN116 pour moduler le métabolisme des graisses.
William Mair, un des auteurs de l’étude, déclarait : « Notre travail montre à quel point la plasticité des réseaux de mitochondries est cruciale pour les bénéfices du jeûne. Si nous bloquons les mitochondries dans un état, nous bloquons complètement les effets du jeûne ou des restrictions alimentaires sur la longévité. » Il n’est donc pas abusif d’utiliser le terme « santé mitochondriale » pour mettre en valeur ces pratiques qui permettent de vivre bien et longtemps. Ce terme ne doit toutefois pas être réduit à l’absence de maladie mitochondrialeN111.
Un bémol à cette présentation vertueuse de la restriction calorique : elle n’est pas recommandée lorsque l’organisme est en proie à une infection : grippe, coronavirus etc. — voir mon article CoVID-19 : immunité, style de vie.
⇪ Le jeûne et l’exercice
Quel que soit le protocole choisi, les pratiques régulières de restriction calorique, même associées à une nutrition équilibrée, ne sont pas suffisantes pour éviter l’accumulation de surpoids sur le long terme. Elles doivent être associées à de l’exercice, au minimum sous les formes « calibrées » décrites sur ce site, une hydratation satisfaisante et la régularité du sommeil.
On peut se demander s’il est avantageux de pratiquer de l’exercice pendant la période de jeûne ou de restriction calorique. La réponse dépend des individus — il suffit d’essayer — mais quelques indications peuvent être utiles.
En insérant une séance d’exercice de haute intensitéN96 avant la rupture du jeûne, le bénéfice de l’hormone de croissance humaine (HGHN98) peut être augmenté. Faire de l’exercice au terme d’un jeûne de plus de 14 heures active autant d’autophagieN56 que jeûner pendant plusieurs jours. Cette autophagie assure un recyclage des protéines et des organites non fonctionnels. Ce processus permet par ailleurs de produire plus d’AMPKN115 et de NAD+N117 tout en inhibant le mTOR (cible de la rapamycine chez les mammifèresN118).
Consommer des protéines après l’exercice à jeun réactive mTOR, arrêtant ainsi l’autophagie et démarrant le processus de reconstruction (Liu GY & Sabatini DM, 2020N119). Ces deux processus doivent être activés de manière cyclique pour optimiser la santé.
Précaution en ce qui concerne le cancer : stimuler le processus [d’autophagie] pourrait être pertinent pour lutter contre des tumeurs précoces, de petites tailles mais contre-productif dans le cas de cancers plus avancés (Anso J, 2023N97).
Des études comme celle de Van Proeyen K et al. (2011N120) ont comparé les performances d’athlètes sur plusieurs semaines d’exercice d'endurance avec un groupe jeûnant pendant l’entraînement et l’autre recevant un apport glucidique : 160 grammes avant la séance, puis 1 gramme par kilo de poids et par heure pendant la séance. L’entraînement avec jeûne s’est révélé plus efficace pour l’augmentation de la capacité oxydative musculaireN121 — la capacité des muscles à utiliser l’oxygène, mesurée en microlitres d’oxygène par gramme de muscle par heure. De plus, le jeûne facilite la dégradation des lipides intramyocellulairesN122 — les gouttes de graisses stockées dans les cellules musculaires. Enfin, le jeûne a empêché la diminution de la glycémieN123 pendant l’exercice.

Ce résultat paradoxal s’explique par le fait que la privation de nourriture oblige le corps à consommer en premier sa réserve de sucre stocké sous la forme de glycogèneN32. Lorsque cette source est épuisée, ce qui est assez rapide, il puise dans la réserve beaucoup plus vaste de graisse stockée dans les cellules adipeuses.
Jason Fung compare notre organisme à un camion citerne transportant du carburant, qui brûle en premier celui contenu dans son réservoir, et directement accessible (voir pageN124). S’il tombe en panne, il a la possibilité d’accéder à sa cargaison, mais l’accès en est moins immédiat :
De la même manière, nous transportons une grande quantité d’énergie sous forme de graisse. Mais nos muscles sont habitués à fonctionner au sucre, et ils tombent en panne d’énergie, ce qui fait que nous avons sans arrêt besoin de refaire le plein, malgré le grand réservoir de carburant stocké sous forme de graisse.
Dans le cas du jeûne associé à de l’entraînement, il faut compter quelques jours ou semaines pour que l’organisme prenne l’habitude d’utiliser l’énergie stockée dans les réserves de graisse. Ce mécanisme de cétogenèseN125 est facilité par l’adoption d’un régime pauvre en glucides et riche en graisses. Ce constat a incité des équipes d’athlètes à opter pour cette pratique nutritionnelle.
Il est important de noter que l’avantage en termes de performances sportives est associé à une pratique de jeûne — de courte durée — et non de restriction calorique. La différence pourrait venir du fait que le métabolisme de baseN126 (dépense d’énergie minimum quotidienne permettant à l’organisme de survivre) diminue pendant la restriction calorique afin que l’organisme s’adapte à son environnement, alors qu’il augmente pendant les premiers temps du jeûne, comme si l’organisme était « incité » à partir chercher de la nourriture.
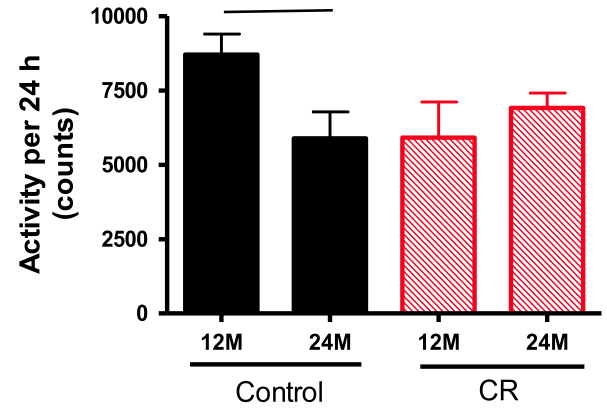
L’étude Behavioural changes are a major contributing factor in the reduction of sarcopenia in caloric-restricted ageing mice (Norren K et al., 2015N127) présente les effets de la restriction calorique sur la perte de masse musculaire liée au vieillissement (sarcopénieN128) dans une population de souris. La restriction calorique augmente la durée de vie tout en limitant la sarcopénie (et en préservant la densité minérale osseuseN129) alors que les animaux qui la subissent ont une masse musculaire un peu inférieure au groupe témoin pendant leur jeunesse. Cette limitation de la sarcopénie serait liée à une modification du comportement : les sujets deviennent plus actifs en vieillissant, notamment par la pratique d’efforts intensifs de courte durée avant les repas du fait de l’attente de nourriture. Associée à une meilleure sensibilité à l’insuline, cette pointe d’activité facilite la synthèse de protéines. Appliqué aux humains, ce résultat confirme l’intérêt de l’entraînement fractionné de haute intensitéN96 en amont d’un repas riche en protéines et pauvre en glucides. (Voir une discussion de cet article en anglais, N130.)
⇪ Quelques données expérimentales
La proposition du demi-jeûne fractionné trouve sa place dans un cadre général que l’on appelle nutrition restreinte dans le temps (TRF, Time-Restricted Feeding). Les chercheurs du Salk Institute à La Jolla (Californie) ont étudié les temps de prise de nourriture de 150 individus adultes, pendant 3 semaines, à l’aide d’une application sur smartphone (voir Gill S. & Panda S., 2015N131). Ils ont constaté que les rythmes de prise de nourriture étaient très variables d’un jour à l’autre, tandis que plus de la moitié des sujets s’alimentaient sur une période de plus de 15 heures par jour. Plus de 35 % des calories étaient absorbées après 18h. Les durées de sommeil décroissaient à mesure que la période de prise de nourriture s’allongeait.
Par contre, si l’on imposait à des sujets en surpoids une période d’alimentation de 10 à 11 heures pendant 16 semaines avec un support visuel (feedogram), ces personnes perdaient du poids, retrouvaient de l’énergie et dormaient mieux.
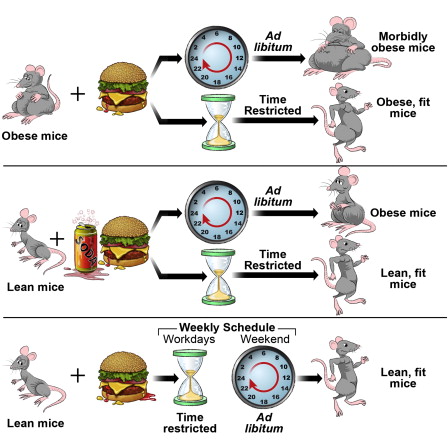
Cette étude vient en confirmation de travaux expérimentaux menés sur des souris, Time-Restricted Feeding Is a Preventative and Therapeutic Intervention against Diverse Nutritional Challenges (Chaix A. et al., 2014N132). Lorsque les animaux ont la possibilité de se nourrir à tout moment, ils ont tendance à devenir obèses, alors que ceux qui n’ont accès à la nourriture 8 à 9 heures par jour restent minces, et cela malgré que les deux groupes absorbent la même quantité de nourriture.
D’autre part, les souris soumises au jeûne fractionné (TRF) avaient un moindre niveau d’inflammation systémique (N133 ou N134), de stéatose hépatiqueN135 (foie trop gras), de « mauvais cholestérol » et de troubles métaboliques que celles nourries sans TRF.
Les avantages du jeûne fractionné sont maintenus si la contrainte est relâchée pendant une courte période, ce qui correspondrait aux week-ends chez les humains.
Les chercheurs concluent que, pour les humains, un jeûne nocturne de 10 à 12 heures pourrait être aussi efficace que la restriction calorique pour lutter contre le surpoids. Ils supposent que ce jeûne fractionné « remet à l’heure » l’horloge biologique circadienneN85 qui avait été déréglée par la prise de nourriture irrégulière, et par conséquent restitue à l’organisme sa capacité de brûler les calories excédentaires.
Une revue de 18 travaux en expérimentation humaine sur la nutrition restreinte dans le temps (TRF) a été publiée par Jéssica do Nascimento Queiroz et al. (2020N136). La plupart de ces études confirment les effets bénéfiques de cette pratique en termes de réduction de l’obésité, amélioration du sommeil et d’autres paramètres biologiques. Celles qui n’étaient pas concluantes portaient sur des sujets jeunes et/ou bien entraînés. Les auteurs concluent :
Les avancées dans le domaine de la chrononutrition révèlent que, outre ce qu’il faut manger et en quelle quantité, le moment où il faut manger peut également être déterminant pour la santé. Des études humaines examinant les effets de la TRF sur la santé cardio-métabolique sont apparues récemment. Dans cette revue, nous avons observé des résultats divergents des interventions de TRF. Cela peut être dû au fait que le nombre relativement faible d’études existantes a été mené auprès de populations différentes, avec des conceptions non contrôlées et à court terme, et avec différentes durées et moments de la journée pour la fenêtre de repas. Malgré cela, la TRF peut être une approche prometteuse pour promouvoir la perte de poids et l’amélioration de la santé cardio-métabolique des personnes en surpoids et obèses. Bien que cela puisse être particulièrement vrai lorsque la fenêtre de repas est placée vers le début de la journée avec la période de jeûne à la fin de la phase biologique active, des recherches supplémentaires sont nécessaires pour le confirmer. Par conséquent, les effets de la TRF à différents moments de la journée sur la santé cardio-métabolique humaine, ainsi que la sécurité, l’efficacité et la viabilité de cette approche diététique chez les personnes souffrant de déficiences cardio-métaboliques et chez les personnes âgées devront être évalués dans le cadre d’études contrôlées et à long terme.
Toutefois, ils reconnaissent (2020N136 page 5) :
[…] on ne sait toujours pas si les effets bénéfiques de la TRF observés chez l’homme sont dérivés de la restriction énergétique, de la perte de poids ou de la délimitation d’une période d’alimentation en soi. Quoi qu’il en soit, la découverte que la TRF peut être une stratégie simple pour promouvoir une réduction de l’apport énergétique peut indiquer son utilité en tant que stratégie comportementale pour promouvoir la perte de poids et ses avantages connexes pour la santé.
⇪ Quid du petit-déjeuner ?
Dans un exposé brillant (Kealey T, 2019N137) qui débute par son témoignage sur des pratiques de fraude en sciences médicales dont il a été le témoin pendant ses études (à l’Université d’Oxford UK), Terence KealeyN138 raconte son expérience de diabétique de type 2 et la prescription que lui avait fait son médecin de faire trois repas par jour et d’y consommer des glucides lents, notamment un petit-déjeuner à base de flocons d’avoine… Il avait suivi la recommandation inverse, s’étant muni d’un glucomètre qui révélait un pic « explosif » de glycémie après un tel petit-déjeuner. Il avait donc simplement supprimé le petit-déjeuner et « renversé » ainsi son diabète de type 2. Il a donc publié l’ouvrage Breakfast Is a Dangerous Meal (2017N139) pour faire connaître cette pratique.
Les « preuves » fournies par Kealey à l’appui de sa thèse sont des études interventionnelles randomisées et contrôlées, mais sur de petits groupes et sans suivi sur le long terme. Plus grave, elles ne pouvaient pas respecter la procédure de double-aveugleN140 puisque les sujets étudiés savaient ce qu’ils mangeaient (ou ne mangeaient pas). Par contre, des études portant sur de grands nombres de sujets et de longues durées ont abouti au résultat inverse, comme par exemple The Nurses Health StudyN141, une vaste cohorte prospective qui a étudié les habitudes alimentaires de plus de 46 000 femmes, avec une période de suivi de six ans. Les chercheurs de l’université de Harvard ont constaté que la consommation fréquente d’un petit-déjeuner semble avoir un effet protecteur contre le diabète de type 2, les femmes qui prenaient un petit-déjeuner sept jours par semaine présentant un risque inférieur de 20 % par rapport à celles qui ne le prenaient pas régulièrement. Cette relation était vraie même après ajustement de l’IMC. D’autres études sur des hommes adultes et des adolescents, mentionnées par un consultant (2017N142), confirment ce résultat. Ce consultant expose des faits de chronobiologie qui sont décrits plus bas.
Que retenir de cette expérience ? Le petit-déjeuner est-il en lui-même un repas « dangereux » (pour les diabétiques), ou le problème résidait-t-il dans les flocons d’avoine et autres « glucides lents » ? Quid d’un petit-déjeuner sans glucides, avec des protéines et des graisses de bonne qualité — comme dans une diète cétogène ou en chrononutrition ?
La mode de « sauter le petit-déjeuner » (skipping breakfast) s’est répandue aux États-Unis en raison du contenu nutritionnel des petit-déjeuners : les fameuses « céréales » popularisées par Kellogg’s. Malheureusement, de nombreux adeptes de « médecines naturelles », en France, se contentent de ces trois mots en guise de recette contre l’obésité et le diabète… Ignorants du fait que les petit-déjeuners « pain-beurre-confiture » sont une coutume récente. J’ai entendu une soignante dans une maison de retraite se plaindre de « ces vieux à qu’on n’arrive pas à faire manger du sucré au petit-déj’ »…
L’étude de Bo S et al. (2015N143) confirme l’intérêt de la nutrition restreinte dans le temps, mais aussi la pertinence de supprimer le dîner plutôt que le petit-déjeuner dans une pratique de jeûne fractionné visant un meilleur contrôle de la glycémie. La résistance à l’insuline (voir mon article Insulinorésistance) est en effet plus forte en soirée, ce qui diminue l’élimination du glucose en excès dans le sang pendant la nuit. Ils concluent :
Le même repas consommé dans la soirée [plutôt qu’au petit-déjeuner] a entraîné un RMR [métabolisme de repos, Resting Metabolic RateN144] plus faible et des réponses glycémiques/insulinémiques accrues, ce qui suggère des variations circadiennes dans la dépense énergétique et le profil métabolique d’individus en bonne santé.
Le repas qui a été déplacé (entre le soir et le matin) était relativement riche en graisses (31 %) et en protéines (30 %) dans cette population recrutée à Turin (Italie). La mode de skipping breakfast (se passer de petit-déjeuner) devenue populaire aux USA pour « perdre du poids » est à mettre en perspective avec le contenu des petit-déjeuners américains : céréales sucrées, lait, jus de fruits industriels etc. Supprimer un tel repas ne peut être que bénéfique… Exporter cette pratique dans des pays qui bénéficient de beurre et fromages artisanaux et d’œufs comme sources de graisses et protéines de bonne qualité me paraît irréfléchi.
Singh RB et al. (2019N145) sont parvenus à la même conclusion au terme d’une étude interventionnelle sur deux groupes de 11 adultes qui devaient prendre, soit le dîner soit le petit-déjeuner pendant 4 semaines, puis inverser leur pratique après une interruption de 4 semaines :
Manger le soir peut prédisposer à l’obésité, à l’obésité centrale et à une augmentation de la glycémie à jeun et de l’HbA1c [hémoglobine glyquéeN146] qui sont des indicateurs du syndrome métabolique [N147]. En revanche, manger le matin peut diminuer l’HbA1c et la pression artérielle systolique, ce qui indique qu’il peut être protecteur contre le syndrome métabolique.
Dans son article Intermittent fasting is homeopathy-level #nothingsauceN148, Bill Lagakos souligne aussi l’avantage d’un early Time-Restricted Feeding (eTRF) qui consiste à se nourrir en début de journée, sur le late Time-Restricted Feeding (lTRF) très pratiqué aux USA, dans lequel on se nourrit surtout en fin de journée. Il souligne que l’intérêt du TRF repose plus dans le rétablissement d’un cycle circadien régulier que dans la restriction calorique qui reste minime. Pour lui, le lTRF a pour effet de perturber l’horloge interne naturelle des cellules, et en particulier des cellules musculaires, puisque leur temps de travail est fixé pendant la journée. Il est prudent de ne pas reproduire de manière irréfléchie une pratique vérifiée sur des souris puisque leurs cycles d’activité diurne/nocturne sont différents de ceux des humains.
L’article d’Affinita A et al. (2013N149) souligne l’erreur qui consiste à se passer de petit-déjeuner en s’appuyant sur une approche multidisciplinaire en biologie, histoire, sociologie et anthropologie… Ils écrivent :
Une revue systématique de la littérature, comprenant 45 études publiées entre 1950 et 2008, a montré que la consommation de petit-déjeuner avait un effet positif sur les performances cognitives, en particulier sur la mémoire et la capacité d’attention, en particulier dans la seconde moitié de la matinée, lorsque ces compétences déclinent. […]
Le petit-déjeuner aide également à réguler l’apport énergétique pendant le reste de la journée. En fait, en raison du sentiment de faim grandissant, les enfants et les adolescents qui sautent régulièrement le petit-déjeuner ont tendance à manger plus de nourriture au prochain repas, en particulier des aliments à haute densité et riches en matières grasses. […]
Bien que toutes les données rapportées soulignent le rôle important que joue le petit-déjeuner dans le maintien de la santé et du bien-être d’un individu, les données épidémiologiques sur les pays industrialisés révèlent que de nombreuses personnes prennent un petit-déjeuner insalubre sur le plan nutritionnel ou l’ignorent complètement. Le manque de temps et le manque d’appétit au réveil sont les principales raisons invoquées. En outre, les adolescents croient à tort que le fait de sauter le petit-déjeuner peut les aider à contrôler leur poids, tandis que les personnes âgées souffrent d’une altération de leur rythme de faim/appétit.
La qualité du petit-déjeuner est un facteur déterminant selon la chronobiologie de la nutrition. Édouard Courot écrit (2016N60 pages 91–92) :
La sensibilité des récepteurs à l’insuline varie de façon circadienne. Le matin, celle-ci atteint son maximum. Un apport d’une charge glycémique élevée aboutira à une décharge massive d’insuline qui entrainera une saturation des récepteurs et une désensibilisation de ceux-ci. De plus, cette hypersensibilité matinale des récepteurs sera responsable d’une diminution tellement importante de la glycémie que l’on pourra observer une hypoglycémie secondaire dans les quelques heures qui suivront le repas. Cette hypoglycémie expose à un coup de faim en deuxième moitié de matinée propice au grignotage qui engendrera un nouveau pic d’insuline avec toutes les conséquences métaboliques qui s’ensuivent : stockage donc prise de poids et désensibilisation des récepteurs. […]
Une étude comparative menée en 2015 [N150] sur des patients diabétiques a pu […] montrer que l’équilibre glycémique était nettement amélioré lorsque ceux-ci suivaient un régime alimentaire dont la quantité de calories étaient décroissante au fur et à mesure des repas au cours de la journée (petit déjeuner > déjeuner > dîner).
Enfin, Shuan Rong et collègues (2019N151) ont mesuré, sur un suivi de 6550 adultes de 40 à 75 ans, une multiplication par 1.87 du risque de mortalité cardiovasculaire et par 1.19 de la mortalité en général chez les sujets qui ne prenaient jamais de petit-déjeuner.
L’article de Queiroz JdN et al. (2020N136) confirme que la nutrition restreinte dans le temps (voir ci-dessus) est plus souvent bénéfique lorsque la fenêtre temporelle de nutrition se situe dans les premières heures de la journée, toutefois avec cette restriction (page 6) :
Le fait de limiter la période de repas aux premiers moments de la journée (eTRF) afin de mieux aligner l’alimentation sur les rythmes circadiens peut favoriser certains résultats bénéfiques pour la santé, notamment le métabolisme du glucose. Cependant, la découverte d’éventuels effets délétères sur les lipides sanguins justifie une étude plus approfondie.
Les « lipides sanguins » en question sont notamment les taux de cholestérol qui ont servi de prédicteurs de santé cardiovasculaire dans les études citées. Une mise à jour de cet a‑priori s’impose — voir mon article Pourquoi diminuer le cholestérol ?
Dans leur revue détaillée Chrono-nutrition : From molecular and neuronal mechanisms to human epidemiology and timed feeding patterns, Flanagan et al. (2020N152) confirment le plus grand intérêt de se nourrir le matin pour réduire l’obésité.
Les données utilisées pour toutes ces études sont de nature statistique et doivent être tempérées par la diversité des individus. Le micronutritionniste Denis Riché écritN153 :
Les travaux de Robert Wurtman chez l’animal puis chez l’homme ont […] montré que, chez un sujet déficitaire, on pouvait restaurer le niveau intracellulaire d’un neuromédiateur dans un délai très rapide. L’idée d’un apport chronologique des précurseurs nutritionnels de ces molécules reste donc valide, dans l’état actuel de nos connaissances. Chez un sujet exempt de déficits l’impact de ces précurseurs reste peu visible, les régulations enzymatiques (répression) ou concernant les récepteurs (up et down regulations) permettent de tamponner un apport excessif. Par contre, en cas de synthèse déficiente, l’apport accru et chronologiquement ciblé se montrera efficace. Cela indique que, si on s’en tient au seul problème du fonctionnement cérébral, tout le monde n’aura pas forcément besoin de manger une importante portion de protéines le matin. Cette recommandation profitera plutôt à ceux qui présentent des difficultés à fabriquer leur dopamine à un niveau correct.
⇪ Articles et ouvrages
- L’appellation « jeûne thérapeutique » est-elle fondée ou usurpée ? Éléments de réponse d’après une revue de bibliographie chez l’animal et chez l’homme. Jérôme Lemar (2011N61). Thèse de médecine.
- Fasting : Molecular Mechanisms and Clinical Applications (Longo VD, Mattson MP, 2014N154)
- Meal frequency and timing in health and disease (Mattson MP et al., 2014N155)
- Intermittent Fasting (Harriet Hall, Science-Based Medicine, 2015N156)
- A Periodic Diet that Mimics Fasting Promotes Multi-System Regeneration, Enhanced Cognitive Performance, and Healthspan (Brandhorst S et al., 2015N67)
- La science dévoile le secret de la longévité (Julien Venesson, 2014N157)
- Recherches de la CR SocietyN158
⇪ ▷ Liens
🔵 Notes pour la version papier :
- Les identifiants de liens permettent d’atteindre facilement les pages web auxquelles ils font référence.
- Pour visiter « 0bim », entrer dans un navigateur l’adresse « https://leti.lt/0bim ».
- On peut aussi consulter le serveur de liens https://leti.lt/liens et la liste des pages cibles https://leti.lt/liste.
- N1 · 1dw6 · Jeûne – Wikipedia
- N2 · bypk · Grève de la faim – Wikipedia
- N3 · cq8y · ‘Breatharian’ couple claim they have barely eaten for NINE YEARS and think they only need ‘the universe’s energy’ to live
- N4 · hhat · Inédie ou respirianisme – Wikipedia
- N5 · 4r1o · Le “respirianisme”, ce “dangereux mouvement sectaire” qui prône le jeûne absolu
- N6 · wose · Et la Lumière… ne fut pas !
- N7 · rz2b · Respirianisme : la femme qui ne mangeait rien
- N8 · wxrf · La mort troublante d’une femme qui se nourrissait »d’air et de lumière »
- N9 · aj68 · Qu’est-ce que la détoxination ?
- N10 · 92g5 · Effet yo-yo – Wikipedia
- N11 · c1cv · Régime : a‑t-on enfin trouvé une solution pour éviter l’effet yo-yo ?
- N12 · oms6 · A synaptic amplifier of hunger for regaining body weight in the hypothalamus
- N13 · hklc · C’est quoi l’effet yoyo ?
- N14 · 9anq · Détoxication – Wikipedia
- N15 · dlmy · Résistance à l’insuline – Wikipedia
- N16 · 30ru · Jimmy can only be pitied ; FUNG is a menace who must be stopped
- N18 · crp5 · Minnesota Starvation Experiment – Wikipedia
- N19 · ps8k · Anorexie nerveuse
- N20 · xtho · Natalia Bataeva
- N21 · 7z67 · Le jeûne, un moyen de rester en bonne santé
- N22 · bcd2 · Parent House of the Buchinger Method
- N23 · ovb1 · Valter D. Longo – Academic profile
- N24 · xfsb · Lee, C et al. (2012). Fasting Cycles Retard Growth of Tumors and Sensitize a Range of Cancer Cell Types to Chemotherapy. Sci Transl Med., 4, 124.
- N25 · w5ag · Cheng CW, Adams GB, Perin L, Wei L, Zhou X, Lam BS, Da Sacco S, Mirisola M, Quinn DI, Dorff TB, Kopchick JJ, Longo VD (2014). Prolonged Fasting Reduces IGF‑1/PKA to Promote Hematopoietic-Stem-Cell-Based Regeneration and Reverse Immunosuppression. Cell Stem Cell, 14, 6 : 810–823.
- N26 · fepg · Immunosuppression – Wikipedia
- N27 · swr0 · Vidéo “Le jeûne, enquête sur un phénomène” – YouTube
- N28 · toy6 · Anso, J (2024). Jeûne thérapeutique : la mise en scène (trop) parfaite d’Arte. Site “Dur à Avaler”
- N29 · lcub · Essai randomisé contrôlé – Wikipedia
- N30 · e7vy · Lee, C & Longo, V (2011). Fasting vs dietary restriction in cellular protection and cancer treatment : from model organisms to patients. Oncogene. 2011, 30, 30 : 3305–16.
- N31 · pr0d · Wang et al. (2006). THE COMPARATIVE PHYSIOLOGY OF FOOD DEPRIVATION : From Feast to Famine
- N32 · necd · Glycogène – Wikipedia
- N33 · aua1 · Néoglucogenèse – Wikipedia
- N34 · rscz · Glycérol – Wikipedia
- N35 · 42pq · Corps cétoniques – Wikipedia
- N36 · acd3 · Cahill (1970). Obesity – Book review
- N37 · ciec · Cahill et al (1970). Metabolic adaptation to prolonged starvation in man
- N38 · itzm · Cahill (2006). Fuel Metabolism in Starvation
- N39 · i9gv · Cahill GF & Owen OE (1968). Starvation and survival
- N40 · 9bim · The consumption of fuels during prolonged starvation
- N41 · noh5 · Saudek CD & Felig P (1976). The metabolic events of starvation
- N42 · a5mr · Bloom WL (1959). Fasting as an introduction to the treatment of obesity
- N43 · bgim · Drenick EJ et al. (1964). Prolonged starvation as treatment for severe obesity
- N44 · 4n30 · Thomson TJ et al (1966). Treatment of Obesity by Total Fasting up to 249 Days
- N45 · fr56 · Cubberley PT et al (1965). Lactic Acidosis and Death after the Treatment of Obesity by Fasting
- N46 · gw8j · Spencer IOB (1968). Death during Therapeutic Starvation
- N47 · c1nd · Garnett ES et al. (1969). Gross Fragmentation of Cardiac Myofibrils after Therapeutic Starvation for Obesity
- N48 · 88mk · Runcie J & Thomson TJ (1970). Prolonged Starvation—A Dangerous Procedure
- N49 · 4mh2 · Acidocétose – Wikipedia
- N50 · nvdf · Obésité sarcopénique et altérations du métabolisme protéique musculaire
- N51 · gb3f · Dry Fasting : The Truth About This New Health Industry Trend
- N52 · i60z · Cétose – Wikipedia
- N53 · ki1l · Stookey JD (1999). Another look at : fuel + O2→ CO2+ H2O. Developing a water-oriented perspective
- N54 · lza7 · Le processus des 21 jours
- N55 · l2bm · Groupe sectaire Contact & Muziek
- N56 · 6q20 · Autophagie – Wikipedia
- N57 · tb4q · Video “Is fasting worth it?” – Georgi Dinkov
- N58 · oae4 · Cortisol – Wikipedia
- N59 · 1l4j · Déhydroépiandrostérone (DHEA) – Wikipedia
- N60 · obk3 · Courot E (2016). Importance de la chronobiologie dans la prévention et la prise en charge de certaines maladies notamment cardiovasculaires et métaboliques : exemples de la chronopharmacologie et de la chrononutrition. Thèse de doctorat en pharmacie. Université de Lorraine.
- N61 · 4a14 · Jérôme Lemar (2011). L’appellation “‘jeûne thérapeutique” est-elle fondée ou usurpée ? : éléments de réponse d’après une revue de bibliographie chez l’animal et chez l’homme
- N62 · qso8 · Étude en intention de traiter – Wikipedia
- N63 · oyf0 · Médecine fondée sur les faits – Evidence-based medicine (EBM) – Wikipedia
- N64 · s94t · The Fasting Mimicking Diet
- N65 · nbv1 · The Longevity Diet : Discover the New Science Behind Stem Cell Activation and Regeneration to SlowAging, Fight Disease, and Optimize Weight
- N66 · xapc · Ouvrage “Le régime de longévité” – Valter Longo
- N67 · y7f9 · Brandhorst S et al. (2015). A Periodic Diet that Mimics Fasting Promotes Multi-System Regeneration, Enhanced Cognitive Performance, and Healthspan
- N68 · x4c4 · A diet that mimics fasting may be good for you
- N69 · ydcj · Cétone – Wikipedia
- N70 · od79 · Cellule souche – Wikipedia
- N71 · 5es8 · Protéine kinase A – Wikipedia
- N72 · bc1n · Pluripotence – Wikipedia
- N73 · toq9 · Fasting, Circadian Rhythms, and Time-Restricted Feeding in Healthy Lifespan
- N74 · 3p44 · Jeûne intermittent – Wikipedia
- N75 · 5b1q · How Alternate-Day Fasting Can Help You Achieve Your Weight Loss Goals
- N76 · 11cb · The Other Day Diet
- N77 · xj76 · Ouvrage “Le régime 5:2” – Kate Harrison
- N78 · 3z5v · 5:2 intermittent fasting
- N79 · v8q0 · Site “TheAchievableBody”
- N80 · m2de · How to Use Upselling to Increase Customer Happiness, Retention and Revenue
- N81 · kq7z · Ghréline – Wikipedia
- N82 · jsg6 · Le rôle du cortisol dans l’excès de poids et l’embonpoint
- N83 · 17r9 · Lauwers T (2018). Ouvrage “Au-delà des régimes” – Taty Lauwers
- N84 · vz0s · Is the new ‘fasting’ diet trend healthy ?
- N85 · z1o8 · Horloge biologique circadienne – Wikipedia
- N86 · 05q2 · Circadian clocks govern calorie restriction–mediated life span extension through BMAL1- and IGF-1-dependent mechanisms
- N87 · sb4e · Leptine – Wikipedia
- N88 · 6ve6 · Microbiote intestinal humain – Wikipedia
- N89 · p0a9 · Lactosérum – Wikipedia
- N90 · pf0p · Adams, RL & KS Broughton (2016). Insulinotropic Effects of Whey : Mechanisms of Action, Recent Clinical Trials, and Clinical Applications. Ann Nutr Metab 69,1 : 56–63.
- N91 · yd8q · L’anabolisme et le catabolisme : définition, différence, fonctionnement
- N92 · sz8u · Saladino P (2020). Ouvrage “The Carnivore Diet” – Paul Saladino
- N93 · hk1h · Catabolisme – Wikipedia
- N94 · s5ni · Anabolisme – Wikipedia
- N95 · 3duy · Fasting : Molecular Mechanisms and Clinical Applications
- N96 · w6ci · Entraînement fractionné de haute intensité – HIIT – Wikipedia
- N97 · pk8m · Autophagie et cancer : une arme à double tranchant
- N98 · v2fc · Hormone de croissance humaine – HGH – Wikipedia
- N99 · jxbl · Facteur neurotrophique dérivé du cerveau (BDNF) – Wikipedia
- N100 · a3u9 · Diabète de type 2 – Wikipedia
- N102 · 2e9d · Intermittent versus daily calorie restriction : which diet regimen is more effective for weight loss ?
- N103 · 1nkt · Masse maigre – Wikipedia
- N104 · 81fq · Hormèse – Wikipedia
- N105 · o7rb · Mitteldorf J (2015). Caloric Restriction, Hormesis, and what they teach us about Evolution
- N106 · e6o1 · Restriction calorique, hormèse, et ce que cela nous apprend sur l’évolution
- N107 · 7tsy · Site “CR Society International” – Calory Restriction
- N108 · spik · Mitochondria and Human Disease – mTOR/ Autophagy 4
- N109 · alc0 · Mitochondrie – Wikipedia
- N110 · g2gs · Organite – Wikipedia
- N111 · uqbf · Maladie mitochondriale – Wikipedia
- N112 · bfxi · Dietary Restriction and AMPK Increase Lifespan via Mitochondrial Network and Peroxisome Remodeling
- N113 · lhav · In pursuit of healthy aging
- N114 · c1qb · Caenorhabditis elegans – Wikipedia
- N115 · t3ka · AMPK – Wikipedia
- N116 · 3cfm · Peroxysome – Wikipedia
- N117 · 7kg0 · Nicotinamide adénine dinucléotide (NAD) – Wikipedia
- N118 · o3dy · mTOR – Wikipedia
- N119 · ivb2 · Liu GY & Sabatini DM (2020). mTOR at the nexus of nutrition, growth, ageing and disease
- N120 · ib4r · Beneficial metabolic adaptations due to endurance exercise training in the fasted state
- N121 · 0bzu · Oxidative capacity
- N122 · vdp6 · Intramyocellular lipids – Wikipedia
- N123 · iuhf · Glycémie – Wikipedia
- N124 · lwoq · Fasting and Exercise – Fasting 23
- N125 · 379a · Cétogenèse – Wikipedia
- N126 · uo7d · Métabolisme de base – Wikipedia
- N127 · f2l4 · Norren K et al. (2015). Behavioural changes are a major contributing factor in the reduction of sarcopenia in caloric-restricted ageing mice
- N128 · 2fso · Sarcopénie – Wikipedia
- N129 · it01 · Densité minérale osseuse – Wikipedia
- N130 · sqap · New CR Mice Study Suggests When to Exercise to Preserve Muscles
- N131 · 63k6 · voir Gill S. & Panda S. (2015). A Smartphone App Reveals Erratic Diurnal Eating Patterns in Humans that Can Be Modulated for Health Benefits
- N132 · q7n9 · Chaix A. et al. (2014). Time-Restricted Feeding Is a Preventative and Therapeutic Intervention against Diverse Nutritional Challenges
- N133 · aa6z · Systemic inflammation – Wikipedia
- N134 · kqvd · L’inflammation de bas grade ou inflammation systémique
- N135 · yhbl · Stéatose hépatique – Wikipedia
- N136 · mwx0 · Queiroz JdN, Cauduro R, Macedo O, Tinsley GM, Reischak-Oliveira A (2020). Time-restricted eating and circadian rhythms : the biological clock is ticking.
- N137 · s3cw · Video “Dr. Terence Kealey and the Myth of Scientific Objectivity”
- N138 · y6oi · Terence Kealey – Wikipedia
- N139 · qc2l · Ouvrage “Breakfast is a Dangerous Meal” – Dr. Terence Kealey
- N140 · axd7 · Étude randomisée en double aveugle – Wikipedia
- N141 · l7s9 · The Nurses’ Health Study : lifestyle and health among women
- N142 · yw70 · Breakfast isn’t a ‘dangerous meal’. It’s bad science to say it is – Spectator.co.uk
- N143 · kzvb · Bo S, Fadda M, Castiglione A, Ciccone G, De Francesco A, Fedele D, Guggino A, Parasiliti Caprino M, Ferrara S, Vezio Boggio M, Mengozzi G, Ghigo E, Maccario M, Broglio F (2015). Is the timing of caloric intake associated with variation in diet-induced thermogenesis and in the metabolic pattern ? A randomized cross-over study.
- N144 · pvbz · Resting metabolic rate – Wikipedia
- N145 · 4l0t · Effects of circadian restricted feeding on parameters of metabolic syndrome among healthy subjects
- N146 · xtg6 · Hémoglobine glyquée – HbA1c – Wikipedia
- N147 · kpej · Syndrome métabolique – Wikipedia
- N148 · gtws · Intermittent fasting is homeopathy-level #nothingsauce
- N149 · q4nz · Breakfast : a multidisciplinary approach
- N150 · z3r4 · High-energy breakfast with low-energy dinner decreases overall daily hyperglycaemia in type 2 diabetic patients : a randomised clinical trial
- N151 · uedc · Association of Skipping Breakfast With Cardiovascular and All-Cause Mortality
- N152 · jm7c · Flanagan A, Bechtold DA, Pot GK, Johnston JD (2020). Chrono-nutrition : From molecular and neuronal mechanisms to human epidemiology and timed feeding patterns.
- N153 · c82d · En finir avec la chrononutrition ?
- N154 · ax4y · Longo VD, Mattson MP (2014). Fasting : Molecular Mechanisms and Clinical Applications
- N155 · hz9y · Mattson MP et al. (2014). Meal frequency and timing in health and disease
- N156 · 9h2d · Harriet Hall, Science-Based Medicine (2015). Intermittent Fasting
- N157 · ql9q · Julien Venesson (2014). La science dévoile le secret de la longévité
- N158 · dytr · Calorie Restriction Research Moves forward !
Article créé le 21/08/2015 - modifié le 14/05/2025 à 11h56






 19872
19872


8 thoughts on “Jeûne et restriction calorique”