
Jusqu’à une époque récente, je n’avais qu’une vague connaissance de controverses sur la prescription de statinesN1 en prévention de maladies cardiovasculairesN2 et d’AVCN3. Plus de 10 % des Français sont consommateurs de ces médicaments, mais n’en faisant pas partie je n’étais pas motivé à mieux m’informer. Mes lectures se limitaient donc à quelques pages sur l’Internet francophone et anglophone.
La prévention primaire (avant diagnostic) de ces accidents n’était pas non plus à l’ordre du jour : mes taux sanguins de cholestérol LDL‑C, HDL‑C, triglycérides et cholestérol totalN4 ont été respectivement de 1.21 ± 0.13 g/l, 0.51 ± 0.06 g/l, 0.68 ± 0.16 g/l et 1.85 ± 0.13 g/l entre 2010 et 2016. Dans la même période, le rapport HDL/LDL était 0.42 ± 0.05 et celui du cholestérol total/HDL 3.68 ± 0.31 avec une tension artérielle systolique de l’ordre de 135 mmHg. Ces paramètres étaient « dans les clous » pour un patient sans antécédent cardiovasculaire (voir les taux recommandés : N5)… L’adoption de la chrononutrition en 2009 (voir mon article Chrononutrition - expérience) n’avait pas eu d’impact sur mon bilan lipidique, à l’exception du « bon cholestérol » HDL passé de 0.29 g/l à 0.51 g/l — franchissant la barre du taux minimum recommandé 0.4 g/l.
Cette situation a été renversée fin novembre 2016 par le constat de l’occlusion totale d’une artère coronaireN6 lors d’une angiographieN7 qui a donné lieu à la pose de deux stentsN8 — voir mon article Je suis à l’hôpital ! Il s’agit donc pour moi d’éviter une récidive qui pourrait être fatale, ce qu’on désigne techniquement comme la prévention secondaire d’un accident cardiovasculaire.
Pour cela, plusieurs cardiologues m’ont indiqué une « cible » à atteindre : réduire le taux de LDL‑C en dessous de 1 g/l ou de 0.7 g/l — selon les avis respectifs de la Haute autorité de santé et de la Société européenne de cardiologie…
Quelle que soit la valeur de cet objectif à géométrie variable, “The lower, the better!” On m’a donc prescrit « à vie » des statines : atorvastatineN9 puis pravastatineN10, et pour finir rosuvastatineN11.
J’ai voulu en savoir plus…
Sommaire
⇪ 1 – Question de déontologie
Mon scepticisme sur la prescription de statines s’est heurté à un comportement infantilisant, parfois teinté d’agressivité, auquel je n’avais pas encore été exposé dans le monde médical. Il est vrai que l’hospitalisation fin novembre 2016 était ma première expérience, depuis l’âge de 20 ans, de « client du système de santé » — hormis les soins dentaires. Mais je connais, pour avoir longtemps milité dans les associations d’usager·e·s, les humiliations subies par des femmes qui cherchent à éviter une surmédicalisation de leur accouchement pour en rester « actrices »… Mon engagement à leur côté s’est traduit par l’acquisition de quelques connaissances des pratiques et de la déontologie : création d’une base de références bibliographiquesN12, participation à des groupes de travail à la Haute autorité de santé, et même publication d’un article dans la revue Prescrire (n°312, 2009N13, p. 792–793) à laquelle je contribue occasionnellement (juillet 2016) en tant que relecteur.

Je conçois donc que tout praticien hospitalier est tenu de respecter les protocoles de son service — d’où l’impression désagréable, en l’absence d’explication, que certains fonctionnent en « pilotage automatique » malgré leur dévouement et une parfaite maîtrise du métier.
Tout usager est en droit d’accéder aux bases de connaissances et aux règles éthiques qui sous-tendent la rédaction de protocoles médicaux. Pour cela, en France, des représentants des associations d’usagers du système de santé (agréées par le ministère) sont invités à prendre part à l’élaboration de recommandations de pratique cliniqueN15 dont ces protocoles sont issus. Leur rédaction ne va pas de soi : elle est sujette à controverse pour tout soin ou stratégie de prévention incluant la prescription de médicaments. Les soupçons de conflits d’intérêtsN16 sont en effet récurrents à l’encontre des experts professionnels de santé participant aux travaux.
⇪ Risque juridique
Les collusions entre acteurs du système de santé et industriels du médicament se répercutent à tous les niveaux de l’exercice de la médecine. « Les lobbies sont omniprésents dans les couloirs des hôpitaux », affirme Jean-Sébastien Borde, du Formindep. « Or, le médicament prescrit par le spécialiste aura tendance ensuite à être prescrit par le généraliste à la sortie de l’hôpital » (Lefèvre S, 2016A62). En effet, tout médecin de ville qui prendrait l’initiative de retirer un médicament de la prescription d’un centre hospitalier s’exposerait à un risque, sinon médical du moins juridique. On peut en mesurer les enjeux, dans une branche particulière de la médecine, en lisant l’ouvrage de Bernard Seguy (2006B11).
Un médecin généraliste décrit le dilemne auquel il est confronté, sur un commentaire du blog de Michel de Lorgeril :
Depuis que je me suis intéressé à vos travaux et à d’autres, j’ai tenté de supprimer ces traitements chaque fois que c’était possible, mais cette démarche est très difficile et parfois je renonce. Il existe un tel discours dominant sur la nécessité de traiter le cholestérol — quand ce n’est pas le cardiologue dans son courrier, c’est la médecine préventive qui me signale que j’ai arrêté le traitement par statine alors que le taux de LDL « athérogène » (écrit tel quel dans le compte rendu) dépasse les normes — que le doute, voire la peur, se réinstalle chez le patient et parfois chez moi.
Pour en revenir aux cardiologues qui m’ont « suivi »… Suivez plutôt leur regard : je ne suis à leurs yeux qu’un petit vieux qui refuse de prendre ses médocs ! ? On peut comprendre le « dévouement » de médecins français en vérifiant leurs liens d’intérêts avec l’industrie pharmaceutique dans la base de données publique Transparence-SantéC9.
⇪ La relation patient-médecin
Au cours de mes échanges avec les soignants, je me suis rendu compte que ni les 7 millions de consommateurs de statines en France, ni les soignants qui les prescrivent, n’avaient des arguments solides à verser au débat sur la balance bénéfice-risqueN17 qui devrait être au cœur du dialogue entre patients et médecins. Ceci, dans le respect du Code de déontologie de ces derniers — « en tenant compte des données acquises de la science » N18 — et de l’article L‑1111–4 du Code de la Santé Publique : « Toute personne prend, avec le professionnel de santé et compte tenu des informations et des préconisations qu’il lui fournit, les décisions concernant sa santé »N19. Il est question, plus loin dans ce même texte, de « consentement éclairé ».
Le but de cet article est précisément de contribuer à cet éclairage : où en sont les « données acquises de la science » pour ce qui concerne les statines et autres médicaments anticholestérol ? Ma contribution est celle d’un travail documentaire, à prendre avec précaution puisque l’objet étudié repose sur un savoir théorique et technique hors de mon domaine d’expertise.
➡ Je connais le risque d’extrapoler son histoire personnelle. Un ami chercheur disait : « L’épidémiologie, c’est tout sauf l’histoire de ma voisine ! » C’est pourquoi la suite de cet exposé n’inclut pas de témoignages. L’enjeu principal consiste à interroger le contrat de soin (N20 ; autre N21) entre patient et professionnel de santé, ainsi que l’exactitude et la pertinence des informations à leur disposition.
J’ai consulté de multiples sources afin de ne pas me contenter de « cueillette de cerises » — cherry pickingN22, voir mon article Cerises, brocoli, protéines, propagande. Cet article de non-spécialiste est donc simple work in progress régulièrement amendé et complété par d’autres lectures.
J’insiste pour que les lecteurs concernés — prescripteurs ou consommateurs de médicaments — ne prennent aucune décision avant d’avoir approfondi le sujet. Si Michel de Lorgeril conclut avec conviction que la prescription de statines est à la fois inutile et dangereuse (2015B6), il recommande par ailleurs de ne pas stopper son traitement sans avoir pris l’avis de son médecin traitant — ne serait-ce que par courtoisie — mais aussi parce qu’il est préférable de stopper la statine progressivement, surtout si malheureusement on a été traité à fortes doses (de Lorgeril M, 2013B5, p. 199).
⇪ 2 – Comment lire les publications ?
Les grandes études de prévention primaire (Woscops, AfCaps/TexCaps) et secondaire (4S, Care, Lipid, Avert, Miracl) de la morbi-mortalité cardiovasculaire ont parfaitement démontré que l’utilisation des inhibiteurs de l’HMG-CoA réductase (statines) réduisait la mortalité et la fréquence des pathologies vasculaires d’environ 30 pour 100 chez les patients hypercholestérolémiques et même chez ceux dont la cholestérolémie est considérée comme normale. Cependant, l’usage généralisé des statines est controversé. La question est abordée dans le dernier chapitre de cet article.
Fruchart JC & Duriez P (2017A37) — Encyclopedia Universalis
Le lecteur soucieux de sa santé cardiovasculaire — potentiellement, toute personne à partir d’un certain âge — devrait prendre le temps de lire tous les documents listés en référence de cet article. Plusieurs titres pèchent par sensationnalisme — choix des éditeurs ? — au risque d’attirer les adeptes de théories du complot qui s’épanchent sur les blogs et réseaux sociaux, « contre Big Pharma » et plus radicalement « contre la science », tout en dissuadant les lecteurs capables de faire preuve d’esprit critique…
J’ai laissé ces livres dans ma bibliothèque jusqu’à ce qu’un besoin impérieux d’information m’incite à surmonter mes réticences. Au final, si l’on fait abstraction de leurs titres aguicheurs, ces ouvrages s’appuient sur des données scientifiques, sans autre ambition que celle d’aider le lecteur à repérer les interprétations erronées et les généralisations abusives qui en ont été extraites.
⇪ La santé est une marchandise
Intentionnelles ou accidentelles, les « erreurs d’interprétation » profitent, il est vrai, aux fabricants de médicaments (et à leurs actionnaires). Ce thème est récurrent dans les écrits, entre autres, de Philippe Pignarre (2004B10), Marcia Angell (2005B2) et Peter Gøtzsche (2013B9).
Les manœuvres de lobbies de l’industrie pharmaceutique sont fréquemment dénoncées dans des reportages audiovisuels, comme Le grand bluff du cholestérol réalisé par Anne Georget et diffusé en novembre 2016–2017 sur ARTE. Voir aussi le commentaire de Dominique Dupagne (2016A33), la vidéo d’Émilie Aubry (2017A5) et une émission La Méthode scientifique sur France Culture (Martin N, 2017C6). Christian Lehmann et Martin Winckler avaient déjà lancé l’alerte en 2003 dans un article non publié (2003A63). À signaler aussi, la plainte déposée en France par l’association ANTICOR contre six membres d’un groupe d’expertise sur le cholestérol à la Haute Autorité de santé (HAS) pour avoir négligé de déclarer les liens financiers qu’ils entretenaient avec des laboratoires pharmaceutiques (Santi P et Motet L, 2018A99).
La lecture d’ouvrages et d’articles critiques nécessite une compréhension de base des biais, accidentels ou intentionnels, qui entachent les études cliniques. Je recommande vivement pour cela le livre d’Alexis Clapin : Enquêtes médicales & évaluation des médicaments : de l’erreur involontaire à l’art de la fraude (Clapin A, 2018B3).
Dans cet article, je ne fais qu’effleurer le sujet malgré les alertes lancées sur les essais cliniques qui ont fait croître exponentiellement la prescription de statines en l’absence de preuve de leur contribution à la diminution de la mortalité par accident cardiovasculaire dans les pays industrialisés.
S’il est exact que la vente de médicaments pour la seule prévention des maladies cardiovasculaires représente une part très importante du gâteau de l’industrie pharmaceutique, ce constat devrait inciter les patients/citoyens à s’interroger sur la validité des recommandations qui ont permis l’émergence d’un marché aussi florissant.
J’ai évoqué dans mon article Pourquoi diminuer le cholestérol ? l’abandon de l’hypothèse thrombogénique explicative de la formation de plaque d’athérosclérose au bénéfice — financier ! — de celle du cholestérol « qui bouche les artères ». Notamment le volte-face de Pfizer, en 2000, après son acquisition de Warner Lambert, détenteur du brevet de l’atorvastatineN9, ce qui l’a mis en position de concurrencer Merck et Bristol Myers Squibb sur le marché des statines (Kendrick M, 2022A54).
Je recommande vivement aux anglophones de lire le compte-rendu de Malcolm Kendrick sur le procès qu’il a gagné en 2024, aux côtés d’Aseem Malhotra et Zoe Harcombe, contre le journaliste Barney Calman qui les avait accusés, en 2019, « d’avoir diffusé des informations erronées sur le cholestérol et les statines. Cette désinformation aurait conduit des milliers de personnes à abandonner leur traitement et à subir des crises cardiaques et des accidents vasculaires cérébraux. » (Kendrick M, 2024N24). Le dossier judiciaire contenait des dizaines de mails démontrant une action concertée — et foncièrement malveillante — de personnes œuvrant pour l’industrie pharmaceutique, ou encore d’universitaires financés à millions par cette industrie pour faire la promotion des statines…
⇪ Le savoir ou la certitude
Un travail documentaire sur les productions de la presse scientifique fait toujours apparaître un paysage en demi-teintes. Les problèmes irrésolus, questions ouvertes, erreurs et controverses sont nombreuses… La recherche est le théâtre d’une perpétuelle évolution, procédant à partir d’hypothèses qui font l’objet de vérification expérimentale, de théorisation, de généralisation, et tôt ou tard de réfutation au bénéfice d’une nouvelle hypothèse qui apporte plus de cohérence.
Le cycle de vie de la recherche scientifique ne peut donc pas satisfaire un patient dont la santé, parfois la survie, dépendent de la fiabilité du traitement qui lui a été prescrit. Michel de LorgerilN25, collègue « insoumis » du CNRS que je cite fréquemment dans mes articles, a exposé ce dilemne en préface de son livre L’horrible vérité sur les médicaments anticholestérol (2015B6, p. 18) :
Le scientifique est un sceptique qui vit dans le doute ; il n’est jamais sûr de rien ; il construit des savoirs et il est toujours prêt à faire évoluer les théories ; c’est son métier ; il est dans le doute systématique mais raisonnable, en ce sens qu’il évalue sans cesse la probabilité qu’il soit dans l’erreur. On ne lui demande pas de prendre des décisions.
Le médecin, lui, doit quotidiennement prendre des décisions pour chacun de ses patients. Pour être décisionnel, en toute honnêteté avec lui-même et ses confrères, il se construit des certitudes ; il en connaît le caractère artificiel — parce qu’il est au courant des réflexions des scientifiques qui ne cessent de changer d’avis — et pour se prémunir des fautes professionnelles qu’on pourrait lui reprocher, il adopte des règles d’éthique qui l’aident dans ses décisions qui, souvent, sont risquées. Mais c’est généralement après-coup que le médecin se dit qu’il aurait dû faire autrement ; c’est là que la médecine est un art car certains de ces artistes sont parfois géniaux tandis que d’autres sont plus besogneux et plus prudents.
⇪ Les effets pervers de la concurrence
Dans un contexte de pénurie de moyens, les controverses sont devenues un champ de bataille entre des équipes de recherche qui, faute d’un financement récurrent, doivent lever des fonds publics ou privés pour leurs travaux. En médecine, les intérêts de l’industrie pharmaceutique sont à l’origine de biais de sélection des essais cliniques pour leur présentation dans des conférences — sponsorisées par cette même industrie — ainsi que de biais de publicationN26 dans les journaux de référence, eux aussi sponsorisés.
La lecture erronée de résultats d’études cliniques n’est pas le fait exclusif de laboratoires privés « inféodés » à l’industrie pharmaceutique. Des organismes publics tels que le CNRS en France peuvent y contribuer en raison d’intérêts financiers. En 2018, l’affaire du Lupuzor™, médicament contre le lupus érythémateuxN27, a été révélée au grand public par Le Canard Enchaîné (20 juin 2018 page 4). Le CNRS ayant breveté la formule puis signé un contrat de licence avec le laboratoire ImmuPharma, avait publié un communiqué de presse triomphaliste (ultérieurement supprimé) interprétant de manière incorrecte les résultats de l’étude clinique (voir le communiqué d’ImmuPharma, 17 avril 2018N28). Ces communiqués ont été relayés sans examen critique par la presse médicale (Le Quotidien du Médecin, 18 mars 2018) ce qui a donné lieu à une « demande urgente de renseignements » adressée par les spécialistes de cette maladie à l’initiative de l’association Lupus ErythémateuxN29.
La manipulation de données — plus ou moins intentionnelle — est fréquente dans les sciences biomédicales, comme le montrent les statistiques de rétractation de publications dont on peut avoir une idée sur les sites PubPeer ou Retraction Watch. Les enjeux financiers et de promotion personnelle sont trop forts. Une analyse plus fine (bien que controversée par certains chercheurs ou organismes ciblés) est proposée sur le blog For Better Science de Leonid Schneider. Un exposé très compréhensible sur les méthodes de manipulationN30 a été publié par Milton Packer — voir la version française dans mon article Comment détecter une manipulation de données ?
Publish or perish ! On peut lire sous la plume de Marcia Angell, ancienne rédactrice en chef du prestigieux New England Journal of Medicine (2013N31) :
Le facteur le plus important est la pression concurrentielle existant depuis le développement d’une gigantesque industrie de la recherche, privée et à but lucratif, qui concurrence les centres médicaux dans l’obtention de contrats de recherche pharmaceutique. Ces entreprises privées, appelées SRC (sociétés de recherche sous contrat [NdT : contract research organisations ou CRO]), ont mis en place des réseaux de médecins qui fournissent les patients, et elles ne sont que trop heureuses de mener le travail selon les règles établies par les firmes pharmaceutiques, puisque celles-ci sont leurs uniques clients.
Les sponsors préfèreraient quand même que la recherche clinique la plus importante soit menée dans des hôpitaux universitaires, et cette préférence s’explique en partie par le prestige conféré par ceux-ci. Dans ces conditions de concurrence pour l’obtention des contrats, les centres universitaires se sentent obligés d’accepter des règles autrefois impensables ; et il arrive même qu’ils collaborent avec des SRC pour mener à bien telle recherche.
En plus des subventions pour effectuer tel essai clinique, les investigateurs universitaires ont désormais d’autres liens financiers avec les sponsors de leurs recherches. Ils reçoivent des paiements pour leurs activités de consultants et de membres des conseils consultatifs ainsi que des speakers’ bureaus [NdT : stock de conférenciers prêts à l’emploi] des firmes. Il n’est pas rare qu’ils possèdent des actions ou des titres de participation.
De tels conflits d’intérêts auraient été autrefois interdits par les centres médicaux, mais la donne a changé de ce côté-là aussi, puisque ces institutions ont désormais leurs propres liens financiers, souvent importants, avec l’industrie. De ce fait, elles ne sont guère en mesure de donner des leçons de morale à des universitaires qui font la même chose que la direction des institutions.
Après avoir assisté à un symposium au Wellcome Trust de Londres sur la reproductibilité et la fiabilité de la recherche biomédicale, Richard Horton, rédacteur en chef de The Lancet, a également déclaré (Engdhal W, 2015A35 — version françaiseN32) :
Une grande partie de la littérature scientifique, sans doute la moitié, pourrait être tout simplement fausse. Affligée d’études avec des échantillons réduits, d’effets infimes, d’analyses préliminaires invalides, et de conflits d’intérêts flagrants, avec l’obsession de suivre les tendances d’importance douteuse à la mode, la science a pris le mauvais tournant vers les ténèbres (Horton R, 2015A50).
Ces critiques formulées à l’encontre de travaux biaisés, parfois falsifiés, dénoncent une stratégie de recherche médicale appelée médecine translationnelleN33 « visant à combler le fossé existant entre la science médicale fondamentale et la pratique médicale clinique réelle » . Les limites de cette approche, en termes de qualité scientifique, sont une conséquence directe de la non-reproductibilité de nombreux essais cliniques, exploités malgré cela pour le développement et la mise sur le marché de nouveaux produits. Prinz F et al. (2011A87) ont cherché les raisons de cette non-reproductibilité de résultats théoriques dans les laboratoires industriels :
Il y a aussi un biais en faveur de la publication de résultats positifs, car il est plus facile d’avoir des résultats positifs publiés dans de bonnes revues. Il reste à voir s’il existe effectivement des obstacles à la publication de résultats qui contredisent les données de revues à fort impact, ou l’opinion scientifique actuellement établie dans un domaine donné, ce qui pourrait inciter la littérature à soutenir une hypothèse même s’il existe de nombreuses données (non-publiées) argumentant contre elle. […] Par conséquent, les erreurs passent souvent inaperçues.
⇪ 3 – Les ouvrages

Les éditeurs des ouvrages que je cite en référence — à l’exception ceux de Pignarre, Gøtzsche et Seguy — ont fait un travail de mise en forme des manuscrits qui ne me paraît pas à la hauteur de leurs contenus. Les titres du catalogue de Souccar (« L’Horrible vérité… » etc.) ont fréquemment une tonalité complotiste qui séduit un lectorat « on-nous-cache-tout » mais permet à des faiseurs d’opinion de discréditer l’auteur sans se donner la peine de lire ses livres (cf. PsiramN35)…
Au niveau éditorial proprement dit, les numéros de chapitres mentionnés dans la table des matières ont disparu des en-têtes, rendant aléatoire le suivi des renvois. Mais surtout, les références bibliographiques sont imprécises. Chez Souccar, leurs appels sont même absents du corps du texte… Il est vrai qu’un documentaliste peut reconstruire les entrées incomplètes et les compléter par des liens ou des identifiants pérennes — travail de fourmi qui m’a pris plusieurs semaines. Une telle négligence est regrettable chez un auteur qui répond souvent aux questions sur son site par des arguments d’autorité, de manière évasive en renvoyant les internautes à la lecture de ses livres. 🙁
Les relecteurs de Souccar et du Cherche Midi (s’ils existent) auraient dû convaincre leurs auteurs de ne pas se répandre en points d’exclamation, phrases en majuscules et affirmations péremptoires qui dénaturent la teneur scientifique de leur démonstration. Je me souviens d’avoir été rabroué par des correcteurs de Cambridge University Press pour avoir osé tenter de placer un point d’exclamation dans un de leurs ouvrages (!)
Enfin, un auteur qui instruit à charge un procès contre la corruption du système médical (Even P, 2015B7, livre III p. 411–514) s’expose à un examen sans complaisance de ses propres liens d’intérêt (Le Borgne C, 2015A61 ; Wikipedia, 2017C11).
Ces réserves de forme (et d’intentions) mises à part, la lecture est abordable au plus grand nombre, parfois même agréable. Mais surtout, les arguments sont étayés par des sources fiables (une fois reconstituées, suivre les liens au bas de cette page) : articles de revues scientifiques à comité de lecture.
⇪ 4 – Les statines sont-elles efficaces ?
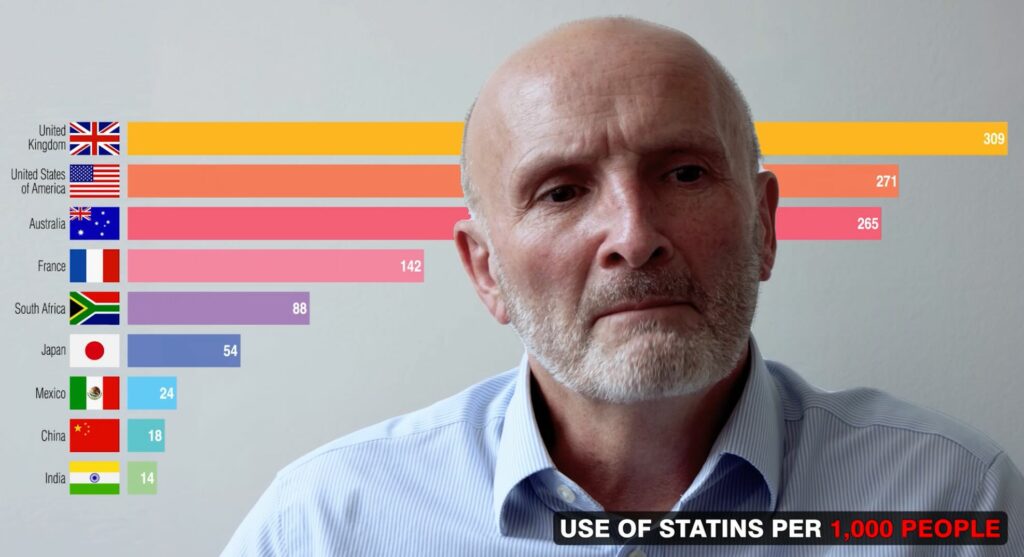
Source : film First Do No Pharm
(Malhotra A, 2024C5 05:28)
Un aperçu historique très parlant de la « bataille du cholestérol », de l’hypothèse lipidique à l’invention des statines, a été publié par Dominique Dupagne (2013A32).
Toutes les statines sont indéniablement efficaces pour « faire baisser le cholestérol », plus précisément diminuer la quantité de cholestérol transporté par les lipoprotéines de basse densité (LDLN36) circulant dans le sang — couramment désignées comme le « mauvais cholestérol » — sans modifier celle des lipoprotéines de haute densité (HDLN37) — le « bon cholestérol ». Les meilleures statines sont celles qui affichent la plus forte baisse, pierre de touche de la compétition entre fabricants.
Dans les essais cliniques, cette diminution mesurable du choelstérol LDL a un effet collatéral : elle permet de deviner qu’un sujet est dans le groupe traité ou le groupe placebo, ce qui revient à contourner la procédure de double aveugleN38. Aucun protocole expérimental ne permettant d’éviter ce biais, nous verrons qu’il peut être exploité pour anticiper les résultats de l’étude, sortir du groupe les « mauvais sujets », ou encore activer une procédure modifiant, en toute légalité, la date de fin de l’essai en jouant sur les critères d’évaluation (end pointsN39).
Revenons à la maîtrise des taux de cholestérolN4 : se traduit-elle automatiquement par une diminution du risque d’accident cardiovasculaire et d’AVC ? J’ai mentionné dans mon article Pourquoi diminuer le cholestérol ? que ce n’était pas le cas d’une réduction des taux provoquée par un régime alimentaire restrictif. En effet, les améliorations associées à certains régimes ne sont pas corrélées au bilan lipidiqueN40, mais plutôt à une multitude d’autres facteurs qui vont de la consommation accrue d’antioxydantsN41 à une plus saine proportion des acides gras polyinsaturésN42 oméga 3 sur oméga 6.
La formation de plaque d’athéroscléroseN43, cause principale de l’infarctus du myocardeN44 et des AVC ischémiquesN3, serait plus le résultat de réactions à une détérioration de l’endothéliumN45 artériel que de la simple accumulation d’un cholestérolN4 en excès. Les mécanismes de cette formation sont complexes, mais ils sont décrits de manière compréhensible dans quelques ouvrages en français (de Lorgeril M, 2011B4, p. 61–165 ; Even P, 2015B7, p. 91–134).
Loin du rôle de « déchet » qui lui avait été attribué lors de sa découverte dans la bile au XVIIIe siècle, le cholestérolN4 est une molécule structurante indispensable aux membranes cellulaires, [un] transporteur sanguin et stockeur cellulaire des graisses, [le] précurseur de multiples hormones et des acides biliaires (Even P, 2015B7, p. 112–113).
Des centaines d’études semblent pourtant, à première lecture, justifier l’utilisation des statines. La doxa médicale préconise (en 2017) leur usage systématique aussi bien en prévention primaire — hypercholestérolémieN46 — que secondaire des accidents cardiovasculaires et des AVC. Les contestataires sont étiquetés comme des marginaux… Les lecteurs anglophones peuvent lire dans le Journal of Controversies in Biomedical Research l’argumentaire de De Lorgeril et Rabaeus (2015A27) sur la prétendue efficacité et innocuité des statines. Un des auteurs (de Lorgeril M, 2016A26) posait déjà la question sur son blog, chiffres à l’appui : Où sont passés les 10 000 décès dus aux arrêts de statines ? Kristensen ML et al. (2015A59) ont comparé les durées de survie sur une période de 2 à 6 ans pour des patients sous statines ou sans traitement, et montré que la différence serait seulement de 5 à 19 jours en prévention primaire et 10 à 27 jours en prévention secondaire.
Il serait fastidieux de faire l’historique des controverses sur l’efficacité de ces traitements. Leur critique est plus ancienne que ne le laisse entendre l’actualité récente. Dès 2004, l’expert judiciaire Marc Girard avait soumis un rapport « tirant à boulets rouges » sur le laboratoire Bayer (2004A79) au sujet de la cérivastatineN47 retirée du marché en 2001 en raison du taux élevé d’effets secondaires graves.
⇪ Des études biaisées
Un argumentaire adressé au lecteur non-spécialiste est disponible dans plusieurs ouvrages de Michel de Lorgeril (2013B5 ; 2015B6) en complément de nombreux articles que ce chercheur a publiés dans la presse scientifique — par exemple, de Lorgeril M (2009A23). Une enquête minutieuse, sur le mode journalistique, de « 14 biais et falsifications des essais cliniques des statines » se trouve dans le livre volumineux de Philippe Even (2015B7, p. 151–175). On lira avec intérêt (p. 164–167) son exposé sur le flou des critères d’évaluationN39.
Premier biais signalé : la population cible des essais cliniques devrait se situer dans la tranche d’âge (au delà de 70 ans) où surviennent la plupart des maladies cardiaques. Selon Even P (2015B7, p. 111) :
Il faudrait, pour mesurer exactement l’efficacité des statines, des essais portant sur des dizaines de milliers de malades, puisque les pourcentages de ceux qui meurent sont très faibles, et poursuivis dix à vingt ans entre 65 et 80 ans, puisque la plupart des accidents se produisent après 70 ans. Situation insoluble pour des raisons de coût, de qualité de suivi et de temps, aucune firme ne pouvant attendre quinze ans les résultats de traitements qui ne seraient plus protégés par des brevets à la fin des essais et qui, d’ailleurs, pourraient voir surgir à tout moment des molécules plus efficaces.
D’où la grande faiblesse des essais randomisés et comparatifs sur les statines. Tous n’ont été conduits que sur des périodes de temps de deux à sept ans, sur au mieux 2000 à 20 000 patients (en moyenne 7000), sur des sujets en moyenne de 59 ± 10 ans, poursuivis jusqu’à 64 ± 10 et interrompus bien avant l’âge moyen des complications cardiaques. Évaluer les statines de 60 à 65 ans, c’est lancer la mouche où les truites ne sont pas. Clairement, ces essais cliniques condamnés d’avance sont menés pour ouvrir un marché, pas pour répondre à une véritable question scientifique. Il s’agit de créer un buzz médiatique, pas de démontrer quoi que ce soit. Du vent.
Il existe une différence notable entre les conclusions des essais cliniques selon que leurs résultats ont été divulgués avant ou après la mise en place de la nouvelle règlementation qui a suivi le scandale sanitaire du médicament VioxxN48 en 2004. Voir discussion sur (Bollapragada SS et al., 2007A9) et suivre les liens sur le règlement des essais cliniques dans l’UE (2014B12). Quelques points essentiels :
- Toute étude clinique doit être déclarée aux autorités compétentes avec des dates précises de début et de fin, et ses résultats rendus publics dans les mois qui suivent la fin de l’étude (cf. ClinicalTrials.govC4).
- Les résultats d’un essai doivent être publiés, que l’hypothèse primaireN49 — l’efficacité du traitement — ait été vérifiée ou non. Cette recommandation est loin d’être respectée en France, même en 2018, puisque la moitié des essais cliniques des CHU ne sont pas publiésN50…
- Tous les auteurs doivent afficher dans la publication leurs liens d’intérêt avec l’industrie pharmaceutique.
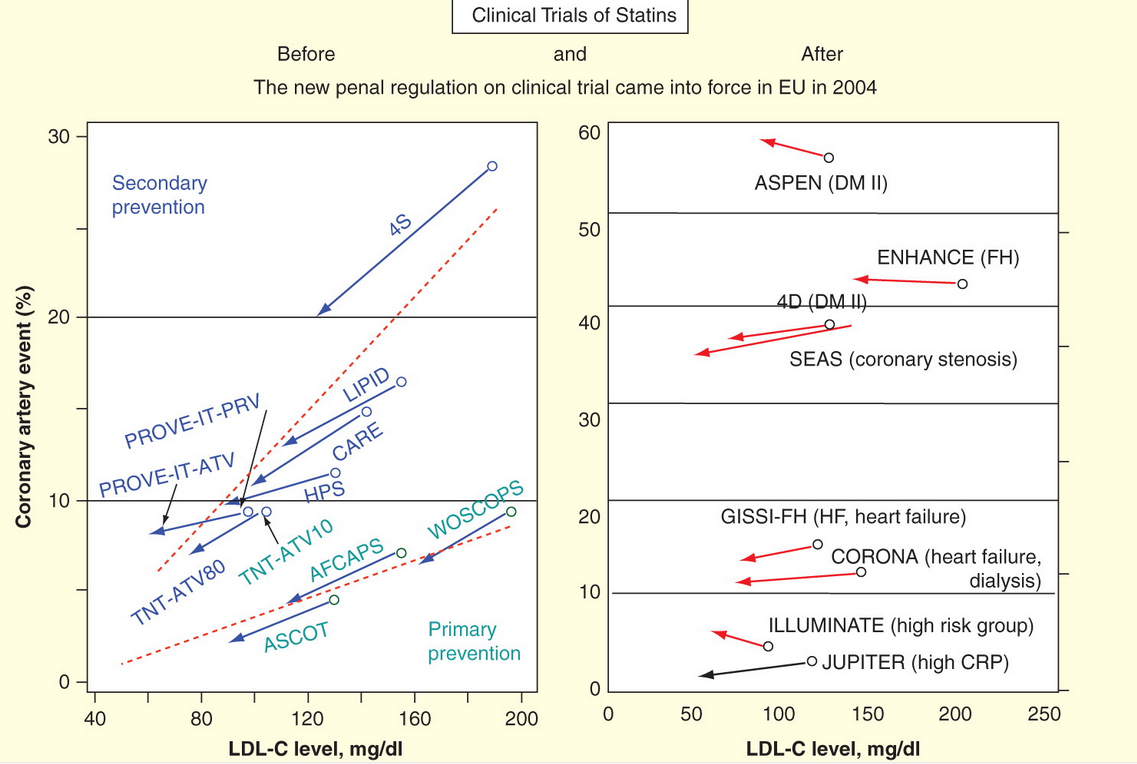
➡ Attention au changement d’échelle entre les deux figures !
Sur la figure ci-dessus, l’origine de chaque flèche indique en abscisse le taux de LDL‑C calculé et en ordonnée le risque absolu d’accident cardiovasculaire des sujets du groupe placebo, et l’extrémité de la flèche ceux du groupe traité. Les flèches sont toutes dirigées vers la gauche, puisque la statine diminue le cholestérol dans tous les cas, et elles devraient aller vers le bas si l’effet annoncé est vérifié. En tenant compte d’un changement d’échelle verticale qui accentue la différence, on voit que l’effet est moins marqué pour les essais postérieurs à 2004, voire négatif (flèches montantes) pour ASPEN, ILLUMINATE et ENHANCE.
La conclusion des auteurs d’ASPEN pour la prévention des accidents cardiovasculaires chez des sujets diabétiques vaut le détour (Knopp RH et al., 2006A58) :
Les réductions des critères finaux composites n’ont pas été statistiquement significatives. Ce résultat peut être lié à la conception globale de l’étude, aux types de sujets recrutés, à la nature du critère d’évaluation principal et aux modifications de protocole requises en raison de la modification des directives de traitement. Pour ces raisons, les résultats de l’étude atorvastatineN9 sur la prévention des effets coronariens sur le diabète sucré non insulino-dépendant (ASPEN) n’ont pas confirmé l’avantage du traitement, mais n’empiètent pas sur la nécessité pour la majorité des diabétiques de risque de maladie coronarienne de mériter un abaissement du cholestérol LDL, conformément aux objectifs actuellement recommandés.
En clair, ne tenir aucun compte du résultat négatif de l’étude ! Son financeur (Pfizer) peut être rassuré…
Selon Tao Chen et al. (2019A15) qui ont analysé 389 essais entre 2011 et 2015, le critère principal de jugement (résultat primaire) d’un essai clinique randomisé diffère dans au moins 30 % des cas entre le protocole enregistré et la publication, et les essais dont le critère principal de jugement a été modifié ont vu s’accroître de 16 % en moyenne la taille du groupe de traitement. Cette augmentation de taille augmente les chances de validation de l’essai. De plus (p. 4) :
Après avoir comparé les 559 publications restantes avec l’enregistrement [de l’essai clinique] en ligne, nous avons constaté que 4 essais (0.7 %) n’étaient pas enregistrés, que 92 essais (16.5 %) avaient été enregistrés après la fin de l’étude et que 74 essais (13.2 %) avaient été enregistrés sans description ou avec une description imprécise du résultat primaire.
⇪ Conflits d’intérêts
De manière significative, les preuves de l’efficacité d’un médicament anticholestérol en prévention d’accidents cardiovasculaires deviennent moins tangibles, parfois inexistantes, lorsqu’il a fait l’objet d’un essai clinique après 2004… Ce qui suggère, à divers degrés, un dysfonctionnement dans les études antérieures à 2004, qui peut aller de biais de sélection à la falsification de données. Marcia Angell (2008N31) projette ce doute sur la recherche clinique en général, dont les statines ne sont qu’une partie :
Compte tenu des conflits d’intérêts qui imprègnent la démarche de recherche clinique, il n’est pas surprenant d’apprendre qu’il existe des preuves solides du fait que les résultats de la recherche sponsorisée par les firmes sont favorables aux médicaments des commanditaires. Cela s’explique d’une part par la non publication des résultats défavorables, et d’autre part par le fait que les résultats favorables font l’objet de publications répétées, sous forme à peine différente. Sans parler de la réécriture qui fait paraître sous un jour favorable même des résultats négatifs de la recherche sur un médicament.
Les données brutes n’étant pas accessibles, car protégées par le secret industriel, seule une analyse approfondie des articles permet d’en déceler les falsifications. Parmi les plus citées pour légitimer la corrélation entre taux de cholestérol et mortalité par accident coronaire majeur, les publications du Clinical Trial Service Unit d’Oxford (CTSU) au Royaume-Uni (Baigent C et al., 2005A6, p. 1271 ; Prospective Studies Collaborators, 2007A88 et 2010A89) sont un cas typique de présentation « arrangée » des données décrypté par Philippe Even (2015B7, p. 126–132) ainsi que par Mark R .
Il n’est pas anodin de signaler que le CTSUN52 est financé à 95 % par l’industrie pharmaceutique, alors que les auteurs de ces études, qui en sont ses salariés, déclarent l’absence de tout lien d’intérêt avec cette industrie !
Sir Richard Thompson, président du Royal College of Physicians et huit autres collègues ont protesté dans une lettre ouverte (2014A109) :
Nous craignons que le CTSU puisse être perçu comme ayant un conflit d’intérêts majeur dans le domaine de la prévention des maladies cardiovasculaires et de la régulation des lipides, ce qui a un impact sur l’objectivité perçue de l’Unité. […]
Les CTT font partie de l’Unité de service des essais cliniques (CTSU) d’Oxford, qui a effectué de nombreuses études très importantes sur les statines et d’autres agents de modification des lipides avec le soutien des sociétés pharmaceutiques, et a reçu des centaines de millions de fonds au fil des ans. Prenons pour exemple une seule de ces études : REVEAL, financée par Merck Sharp & Dohme qui a développé l’anacetrapib [N53]. Une subvention de 96 millions de livres Sterling a été accordée à l’Université d’Oxford pour le coût de cette étude de plusieurs millions de dollars.
Nous craignons que des conflits d’intérêts financiers et des biais commerciaux importants aient corrompu la base de données sur les statines, ce qui a entraîné une sous-estimation de l’incidence des effets secondaires des statines.
⇪ Falsification
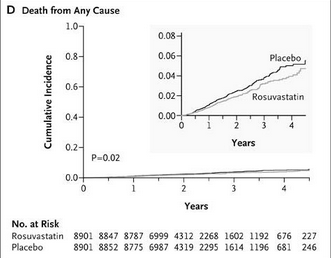
Version 2008A95
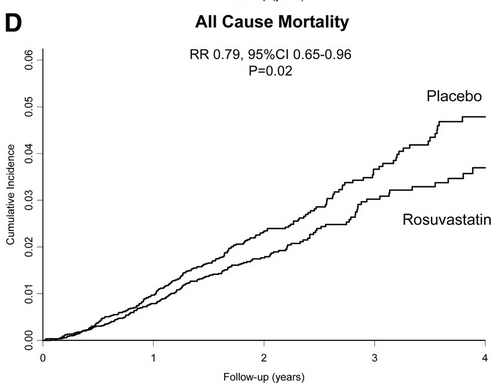
Version 2009A94
Michel de Lorgeril (2013B5, p. 210–211 ; 2012A24) cite comme exemple de falsification, cette fois à l’Université d’Harvard aux USA, deux publications sur l’étude JUPITERN54. Les courbes de mortalité générale qui ont été soumises à la Food and Drug Administration (FDA) lors de la demande de mise sur le marché (Ridker PM et al., 2008A95) ne sont pas identiques à celles publiées un an plus tard (Ridker PM, 2009A94) : une convergence après quatre ans entre les courbes du placebo et de la statine (rosuvastatine ou Crestor®N11) a été « rectifiée »…
Serait-ce parce que l’auteur, confronté à des critiques, avait besoin de « faits alternatifs » pour convaincre son auditoire ? La courbe initiale démontre l’inefficacité de cette statine sur le long terme (de Lorgeril M, 2013B5, p. 210–211).
Là où certains ne voient que des controverses, d’autres affirment qu’il s’agit de fraudes volontaires et on les accuse de polémiquer… Dans d’autres domaines que la biomédecine, des articles présentant des données délibérément falsifiées feraient l’objet de rétractations, leurs auteurs ne pouvant par la suite continuer à exercer que sous l’accoutrement de zombie scientists (Schneider L, 2016A100). Faut-il en conclure que l’usage académique n’est pas le même pour ce qui touche au savoir médical ? Et que ces manipulations de données ne seraient en réalité que de « petites erreurs » commises par les victimes d’une conspiration « anti-science » ? C’est ce que laisse penser le blanchiment de ces pratiques par leurs institutions de tutelle et leur grand élan d’indignation contre les lanceurs d’alertesN55. Voir à ce sujet la réponse, tout aussi indignée mais documentée, de Leonid SchneiderN56.
Dans un article en libre accès, Uffe Ravnskov et collègues (2018A92) concluent ainsi leur analyse critique de trois revues à grande portée publiées par les avocats du traitement par statines :
Notre recherche de falsification de l’hypothèse du cholestérol confirme que celle-ci ne peut satisfaire à aucun des critères de causalité de Bradford Hill et que les conclusions des auteurs des trois revues s’appuient sur des statistiques trompeuses, l’exclusion des essais infructueux et l’ignorance de nombreuses observations contradictoires.
⇪ Autres manipulations
Les manipulations de chercheurs soucieux de prouver l’efficacité d’un médicament (pour satisfaire leurs sponsors) se présentent sous de multiples formes. Toujours dans JUPITERN54, l’interruption de l’essai après un suivi moyen par patient de 1.9 ans au lieu des 4 ans initialement prévus pose problème, dans la mesure où il s’agissait d’évaluer un médicament en prévention primaire, autrement dit chez des patients susceptibles de l’utiliser pendant plusieurs décennies.
Le motif réel de cette interruption pourrait être la survenue de nombreux diabètes de type 2N57 parmi les sujets traités. En tout cas, elle rend inopérante toute vérification de l’hypothèse primaireN49 de l’étude. Après avoir minimisé l’incidence des diabètes dans leur première publication (Ridker PM et al., 2008A95) — sous prétexte qu’ils avaient seulement été « signalés » par les médecins traitants mais pas « validés » en fin d’étude par le comité scientifique — les investigateurs de JUPITER ont admis une augmentation du risque de 28 % dans leur essai, mais en arguant que cela s’était produit sur une période de 5 ans — alors que l’effet fut interrompu après moins de 2 ans… (de Lorgeril M, 2013B5, p. 213)
Trois autres essais du même Crestor®N11 : CORONA (Kjekshus J et al., 2007A56) et GISSI-HF (Tavazzi L et al., 2008A107) avec des patients âgés en insuffisance cardiaque, AURORA (Fellström BC et al., 2009A36) avec des insuffisants rénaux, ont également échoué à démontrer l’efficacité de cette statine, cette fois en prévention secondaire (de Lorgeril M, 2013B5, p. 216–218). Pour GISSI-HF, les auteurs concluent par cette formule elliptique :
La rosuvastatine [N11] à raison de 10 mg par jour n’a pas d’incidence sur les résultats cliniques de patients souffrant d’insuffisance cardiaque chronique d’aucune cause, pour qui le médicament était sans danger (in whom the drug was safe).
⇪ Aucune statine n’a fait mieux
Ces résultats contredisent la pensée dominante selon laquelle la diminution du cholestérol par administration de statines serait d’autant plus bénéfique que le risque d’infarctus est plus élevé… De par sa plus grande efficacité dans la diminution du cholestérol, le Crestor® était la statine la plus qualifiée pour prouver cette théorie.
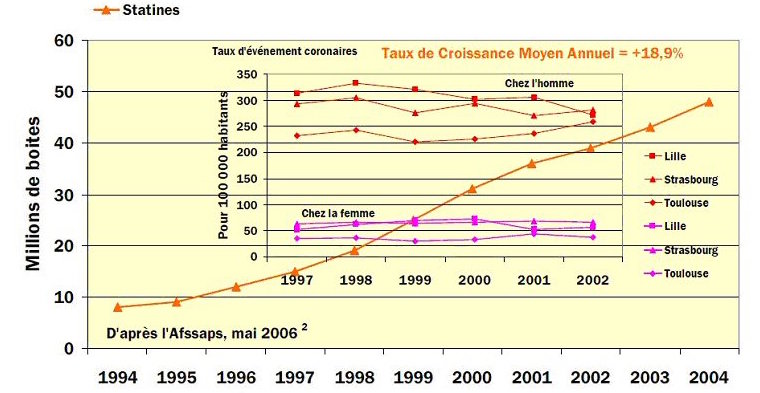
Comme le montre l’exemple ci-dessous extrait de l’étude OMS/MONICA (Dujardin JJ & Cambou JP, 2005A31), l’augmentation considérable de la consommation de statines (+18.9 % par an en moyenne) ne s’est pas traduite, en 10 ans, par une diminution sensible des événements coronaires chez les hommes et femmes d’âge moyen.
La méta-analyse de Paula Byrne et collègues (2022A12) met l’accent sur l’importance d’évaluer l’efficacité en termes de risque absolu, et non relatif :
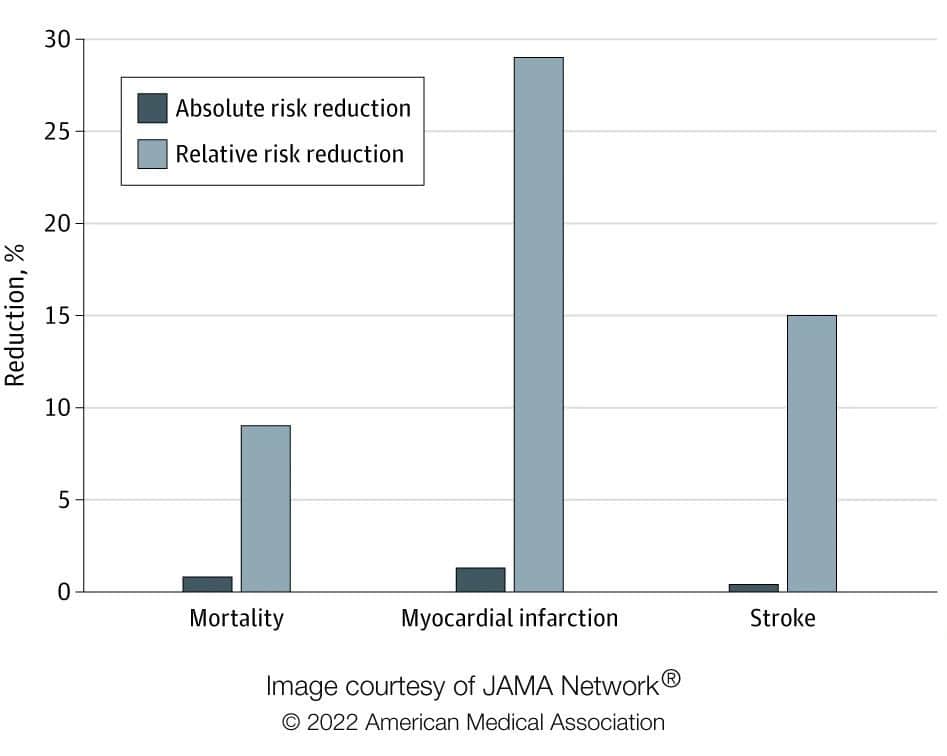
Les résultats de cette méta-analyse suggèrent que les réductions du risque absolu du traitement par statines en termes de mortalité toutes causes confondues, d’infarctus du myocarde et d’AVC sont modestes par rapport aux réductions du risque relatif, et la présence d’une hétérogénéité significative réduit la certitude des preuves. Une association concluante entre les réductions absolues des taux de LDL‑C et les résultats cliniques individuels n’a pas été établie, et ces résultats soulignent l’importance de discuter des réductions du risque absolu lors de la prise de décisions cliniques éclairées avec chaque patient.
Pour mieux comprendre la distinction entre risque relatif et risque absolu, lire l’article Risque alimentaire : la notion de taille d’effet pour le quantifier (2023C7) et le résumé d’un article qui traite du dépistage du cancer par mammographie (Gigerenzer G et al., 2010A38) :
En 1996, une étude sur le dépistage par mammographie a fait état, dans son résumé, d’une réduction de 24 % de la mortalité par cancer du sein ; une étude réalisée en 2002 a annoncé une réduction de 21 %. En conséquence, les brochures sur la santé, les sites web et les invitations font état d’un bénéfice de 20 % (ou 25 %). Le public sait-il que ce chiffre impressionnant correspond à une réduction d’environ cinq à quatre femmes sur 1000, c’est-à-dire 0.1 % ? La réponse est non. Dans un échantillon représentatif de neuf pays européens, 92 % des quelque 5000 femmes ont surestimé le bénéfice d’un facteur 10, 100 ou plus, ou ne le savaient pas. Par exemple, 27 % des femmes au Royaume-Uni pensaient que sur 1000 femmes dépistées, 200 mourraient moins d’un cancer du sein. Mais les patients ne sont pas les seuls à être induits en erreur. Lorsqu’on leur a demandé ce que signifiait la « réduction de 25 % de la mortalité due au cancer du sein », 31 % des 150 gynécologues ont répondu que pour 1000 femmes dépistées, 25 ou 250 femmes de moins mourraient.
⇪ 5 – Petits arrangements…
La plupart des publications utilisées aujourd’hui pour justifier l’utilisation de statines sont des méta-analysesN58 portant sur une sélection d’études. Par exemple, celle de Baigent C et al. (2005A6) porte sur 14 essais dont les auteurs reconnaissent qu’aucun d’eux isolé n’était assez concluant, ni au niveau des résultats, ni sur une catégorie particulière de participant. Une méta-analyse permet de faire un saupoudrage de données en contournant les aléas des tirages au sortN59 — fondement de la médecine factuelle — grâce à l’extraction de sous-groupes de participants dans une série d’essais qui ont été au préalable sélectionnés pour valider l’hypothèse de départ (le fameux p < 0.05 des statisticiens)… Dans la méta-analyse de Baigent C et al., les essais, tous antérieurs à 2005, pouvaient aussi contenir des données falsifiées.
Il faut ajouter que quasiment toutes les méta-analyses sont faussées par l’extrême hétérogénéité des populations étudiées et la grande variabilité de style de vie des patients, recrutés dans à peu près tous les pays du monde occidental, en Amérique du Sud et au Japon, des bûcherons de Carélie aux pêcheurs norvégiens et aux parlementaires de Washington et leurs épouses, dans des centaines de centres, par des investigateurs allant de quelques dizaines à plus de 1500 selon les essais (Even P, 2015B7, p. 155–156).
⇪ Comment éliminer un concurrent…
Giovanni FM Strippoli & Jonathan C Craig ont publié dans le New England Journal of Medicine un éditorial au titre provocateur : Le crépuscule des statines après AURORA ? (2009A105). Ils posent la question de l’efficacité des statines en prévention des accidents cardiovasculaires chez des patients insuffisants rénaux, mais leur souci premier est en réalité de réhabiliter les statines. Quitte à remplacer le Crestor® (du laboratoire AstraZeneca) par la simvastatineN60 commercialisée par leur sponsor Merck Sharp & Dohme ? Nous allons voir comment ils s’y prennent…
Ils suggèrent en premier que l’essai AURORA n’avait pas une puissance statistique suffisante, mais leur argumentation s’appuie sur la méta-analyse de Baigent C et al. (2005A6) dont nous venons de souligner la faiblesse.
JC Craig est en réalité l’auteur principal de SHARP, un essai de plus grande envergure (à l’initiative de Merck Sharp & Dohme) sur une population similaire recevant un traitement d’ézétimibeN61 combinée avec de la simvastatineN60. La première publication sur cet essai (2010A102) se limite à rappeler l’hypothèse primaire… L’année suivante (2011A7), ils affichent les résultats concluant à une diminution de 17 % du risque de grave accident cardiovasculaire. Précision : il s’agit d’une diminution relative (en réalité 16 %) car le risque absolu est descendu de 13.4 % dans le groupe placebo à 11.3 % dans le groupe traité. Par ailleurs, aucune incidence sur la mortalité générale n’a été mesurée significativement. Dans la mesure où 50 % des graves accidents cardiovasculaires conduisent à un décès, on peut conclure à une plus grande mortalité des patients traités attribuable à d’autres causes — autrement dit, des effets indésirables. Mais les auteurs se gardent de le mentionner, un « oubli » fréquent dans les études sur les effets des statines. Est-il avantageux pour un patient d’éviter un accident cardiovasculaire mortel si c’est pour avoir un risque supérieur ou égal de mourir d’une autre affection provoquée ou aggravée par le traitement ?
L’étude SHARP est critiquée par Heiner K Berthold et al. (2011A8) qui soulignent que l’association d’ézétimibe et de simvastatine ne procure aucune information sur l’effet d’un des médicaments. L’essai ne démontre pas l’efficacité de la statine. Une approche scientifique rigoureuse aurait exigé la séparation des patients en quatre groupes : un groupe ézétimibe, un groupe simvastatine, un groupe ézétimibe/simvastatine et un groupe placebo. C’est seulement à cette condition qu’on aurait pu conclure à la supériorité du traitement combiné sur chaque médicament isolé.
Par ailleurs, un effet « paradoxal » — pudiquement appelé off-target effect — d’augmentation de la plaque d’athérosclérose de l’artère carotide sous un traitement par ézétimibeN61 a été signalé par Allen J Taylor et al. (2012A108). Enfin, une méta-analyse de 26 essais cliniques de l’ézétimibe couvrant 23499 participants, menée par la Bibliothèque Cochrane, conclut (Zhan S et al., 2018A112) :
L’ézétimibe est un inhibiteur sélectif de l’absorption du cholestérol dont l’effet positif sur les maladies cardiovasculaires reste incertain. Les résultats des études cliniques sont contradictoires, et une évaluation approfondie de son efficacité et de sa sécurité pour la prévention des maladies cardiovasculaires et de la mortalité serait nécessaire.
➡ Seul un lecteur malintentionné pourrait remarquer que la simvastatineN60 était devenue un générique alors que la combinaison ézétimibe/simvastatineN62 était à cette époque brevetée et commercialisée par Merck Sharp & Dohme…
En 2013, Merck a breveté la combinaison ézétimibeN61/atorvastatineN9 commercialisée sous la désignation Liptruzet™. Ici encore, l’atorvastatine de Pfizer était devenue un générique en 2011…
Dans une publication ultérieure (Palmer C et al., 2012A84) — de nouveau une méta-analyse, cette fois sur 80 essais — JC Craig et ses collègues annoncent que le traitement par statines serait sans effet sur des patients dyalisés ou ayant eu une greffe de rein, et concluent à une faible (bien que statistiquement significative) réduction de mortalité cardiovasculaire et de mortalité globale chez des patients en début d’insuffisance rénale. Ils reconnaissent toutefois que les effets indésirables n’ont pas été évalués dans plus de la moitié des études.
⇪ Jouer avec les statistiques

Dans son article sur les « falsifications » (fallacies) de la médecine moderne, Donald W Miller (2015A72, p. 54) montre à quel point la présentation de résultats (exacts) peut en biaiser l’interprétation :
Pfizer, dans une publicité, proclame : « Le Lipitor réduit le risque de crise cardiaque de 36% », sur la base des résultats d’un grand essai randomisé (ASCOT-LLA) [Sever PS et al., 2003A101] dans lequel 10 305 personnes ont été désignées pour prendre du Lipitor [atorvastatineN9] ou un placebo. L’essai a montré que 1.9 % des personnes prenant du Lipitor ont subi une crise cardiaque contre 3 % du groupe placebo.
En termes de réduction du « risque relatif », le pourcentage indiqué par Pfizer dans l’annonce est correct. (Il est calculé en soustrayant 1.9 de 3 et en divisant la différence, 1.1, par 3, ce qui donne 36 %.) Mais, de manière plus réaliste, l’essai a montré que le Lipitor ne réduit le « risque absolu » d’avoir une crise cardiaque que d’un minuscule 1.1 % (1.9 % dans le groupe des statines comparé à 3 % dans le groupe placebo). Les enquêteurs de l’essai sur les statines mettent en exergue une réduction du risque relatif (généralement de 20 à 40 % dans ces essais) plutôt que la faible réduction du risque dans le monde réel (1–2 % chez ceux qui prennent des statines).
Les enquêteurs affichent le risque relatif pour valoriser l’efficacité des statines. Par contre, ils rapportent les effets indésirables en termes de risque absolu, afin de minimiser leur ampleur. Par exemple, si 6 % du groupe des statines souffrent de diabète au cours d’un essai, comparés à 2 % du groupe placebo, ils diront que la prise de statines augmente le risque d’acquérir le diabète de 4 %, et non pas un risque relatif de 66 % de subir cet effet indésirable.
La distinction entre réduction relative et réduction absolue permet de recadrer les messages de médecine préventive adressés au public. Par exemple, il est plus encourageant — bien que strictement équivalent — d’entendre dire que le dépistage du cancer colorectal diminue de 20 % le risque de mourir de cette maladie, que d’apprendre qu’il réduit la mortalité « seulement » de 3 % à 2.4 %.
L’utilisation de la réduction relative de risque (RRR, Relative Risk Reduction) pour caractériser le bénéfice d’un traitement, et de la réduction absolue de risque (ARR, Absolute Risk Reduction) pour caractériser (en les minimisant) ses effets indésirables, est un biais systématique des résumés d’articles décrivant les essais cliniques de statines, comme l’ont montré David M. Diamond et Uffe Ravnskov (2015N63). Ils ajoutent, en citant JUPITER (p. 2) :
En outre, l’ARR de 0.41 point de pourcentage était la combinaison de crises cardiaques mortelles et non fatales. On a peu prêté attention au fait que plus de gens étaient morts d’une crise cardiaque dans le groupe de traitement. Même des chercheurs expérimentés ont peut-être négligé cette constatation parce que les chiffres n’étaient pas explicitement mentionnés dans le rapport. Il faut soustraire le nombre de maladies coronariennes non fatales du nombre de « n’importe quel infarctus du myocarde » pour voir qu’il y avait 11 crises cardiaques fatales dans le groupe de traitement, et seulement 6 dans le groupe témoin.
Malgré les effets minuscules de la rosuvastatine rapportés dans la publication, les résultats de JUPITER ont été présentés dans les médias comme très impressionnants. Dans un article du magazine Forbes, John Kastelein, co-auteur de l’étude, proclamait : « C’est spectaculaire… Nous avons enfin des données solides » montrant qu’une statine protège d’une première crise cardiaque.
L’utilité clinique (ou efficience) d’un médicament dans une stratégie de prévention devrait en réalité être exprimée par le NNT (Number Needed to TreatN64) qui représente le nombre de patients à traiter pour éviter un accident par an. Dans l’essai JUPITER, une ARR de 0.41 % correspond donc à un NNT de 100 / 0.41 = 244 patients.
Philippe Even publie dans son ouvrage (2015B7, p. 179–201) les statistiques recalculées de manière cohérente dans la méta-analyse de 26 essais cliniques, afin de les comparer à celles publiées par le CTSU, qui servent de référence à toutes les recommandations officielles. Les publications des essais ne mentionnent jamais le nombre de patients à traiter (NNT). Selon ses calculs, il serait de 100 à 1000 patients ou plus pour écarter un accident par an, et en moyenne 330 (décès : 2000 en prévention primaire, 350 en prévention secondaire ; AVC : 900 en PP, 2000 en PS ; accident cardiovasculaire majeur : 300 en PP, 150 en PS) (2015B7, p. 182). À raison de 500 à 700 euros de traitement par an pour chaque patient, on peut évaluer le coût de cette prévention en France…
⇪ Interruption d’un essai
Pour ce qui concerne l’essai clinique ASCOT-LLA (Sever PS et al., 2003A101), l’interruption de l’essai sous prétexte que l’atorvastatineN9 avait prouvé son efficacité (après 3 ans au lieu de 5) soulève un grave problème méthodologique (Devroey D, 2003A29). Cette pratique est fréquente. D’aucuns la comparent à une course de chevaux [dont on aurait] arrêté la course quand le favori des organisateurs de la course est en tête de course et pas à la fin de la distance totale à parcourir (de Lorgeril M, 2013B5, p. 317)… Diminuer la durée de l’essai permet aussi de gagner du temps sur la période de validité du brevet.
Nous avons vu que l’avantage annoncé de 36 % dans l’essai ASCOT-LLA correspondait en réalité à une réduction absolue de risque (ARR) de 1.1 %. De plus, dans cet essai, aucun bénéfice n’avait été observé chez les patients à haut risque d’accident cardiovasculaire, y compris ceux qui avaient du diabète, de l’hypertrophie du ventricule gauche et une maladie vasculaire antérieure, ou pour les patients jusqu’à 50 ans, ceux qui souffraient de dysfonction rénale ou qui présentaient un syndrome métabolique. Aucun bénéfice non plus pour les femmes (Diamond DM & Ravnskov U, 2015A30 p. 3).
Michel de Lorgeril (2013B5, p. 317–321) analyse les conditions de réalisation de Scandinavian Simvastatin Survival Study (4S) (Pedersen TR et al., 1994A85), l’essai clinique multicentrique (4444 patients répartis dans 94 centres) le plus fréquemment cité comme preuve « irréfutable » — bien que jamais confirmée dans 24 essais ultérieurs — de l’efficacité de la simvastatineN60 en prévention secondaire : la mortalité cardiovasculaire en 5 ans avait baissé de 9.3 % à 6.1 % et la mortalité globale de 11.5 % à 8.2 % pour des patients dont les taux de cholestérol total étaient de 2.12 à 3.09 g/l (1993A77). Ici encore, l’essai a été interrompu avant la date prévue, et cela dans des conditions qui n’étaient pas liées à une hypothèse pré-établie. De Lorgeril écrit (2013B5, p. 317) :
Cette façon de procéder est inacceptable. Le doute devient un soupçon quand je lis sur Internet, sous la plume du principal investigateur, que l’arrêt de l’essai fut décidé après qu’un nombre précis de décès avaient été atteints. Dans ce cas, les analyses intermédiaires comparatives étaient parfaitement inutiles. Cela suggère que ce nombre de décès (chiffré [à 440] selon une procédure inconnue) aurait été décidé a posteriori. Nous ne saurons jamais le fin mot de l’histoire.
Poursuivant son analyse (op.cit. p. 318), de Lorgeril évoque la possibilité que, plutôt qu’une réduction de la mortalité dans le groupe traité, il ait eu surmortalité dans le groupe témoin :
Dans 4S on doit aussi envisager l’hypothèse que certains centres avec surmortalité aient été surreprésentés dans le groupe témoin. Cela n’est pas impossible car il y a des gradients de mortalité très importants en Scandinavie. […] Si les centres recruteurs à faible mortalité sont surreprésentés dans le groupe traité, on obtient automatiquement moins de décès parmi les patients traités sans que le médicament n’y soit pour rien. L’asymétrie des centres d’investigation est un biais classique en recherche clinique (on en a un exemple extraordinaire avec l’essai ILLUMINATE) et pour s’en prémunir il est généralement exigé de « stratifier » le tirage au sort en fonction des centres recruteurs de façon à ce que les nombres de patients traités par le placebo ou le médicament soient absolument équivalents dans chaque centre recruteur.
Le rapport sur l’essai 4S (Pedersen TR et al., 1994A85 p. 1384) mentionne : “Randomisation was stratified for clinical site and previous myocardial infraction.” Cela n’implique pas pour autant que les groupes « intervention » et « placebo » aient été numériquement égaux sur chaque site. L’essai était conçu pour avoir un mélange équilibré et représentatif de patients dans chaque groupe de traitement sur différents sites, sans garantir un nombre égal de patients dans chaque groupe sur chaque site.
À noter que, le 19 mars 2010, la Food and Drugs Administration aux USA a déconseillé l’utilisation à haute dose (80 mg) de la simvastatineN60 — qui faisait l’objet de l’essai clinique 4S — en raison du risque trop élevé de déclenchement de myopathies (2011B8). On peut aussi rappeler que la logistique et l’analyse statistique de l’étude 4S étaient assurées par l’industriel Merck lourdement impliqué dix ans plus tard dans le procès du VioxxN48.
⇪ La recherche de consensus
La pression du marché de l’industrie pharmaceutique est très forte, comme l’illustre entre autres cette tentative de Novartis de récompenser financièrement les études les plus « parlantes » de ses produits en cardiologie : son comité international de 11 cardiologues experts (world-class peer review panel) s’est auto-dissous par démission de ses membres lorsque l’absence d’éthique a été dénoncée publiquement (Huston L, 2016A53).
Il n’est pas surprenant que les experts des groupes de travail de sociétés savantes chargés de la rédaction de guides de bonnes pratiques, qui se contentent souvent de balayer un grand nombre de publications en ne lisant que leurs résumés, parviennent à un « consensus » en phase avec les « éléments de langage » des industriels de la pharmacie — avec lesquels beaucoup entretiennent des liens d’intérêt. On comprend encore mieux pourquoi la plupart des praticiens de santé qui ne lisent aucune publication scientifique (à supposer qu’ils comprennent l’anglais) se résignent à appliquer les recommandations sans aucun regard critique.
L’idée de fixer une « cible » de 1.0 g/l pour le cholestérol LDL chez les patients à faible risque cardiovasculaire, ou 0.7 g/l chez ceux à très haut risque, ne repose pas sur une base scientifique, comme l’ont montré Hayward RA et al. (2006A49 ; 2012A48). La méta-analyse de Uffe Ravnskov et al. (2016A91) révèle même qu’au-delà de 60 ans, la mortalité serait en association inverse avec le taux de LDL‑C.
François Pesty écrivait sur le blog Voix médicales (2011A86) :
En premier lieu, l’Afssaps elle-même rappelle dans l’argumentaire de ses recommandations [Afssaps, 2005B1], que « les valeurs de la LDL-cholestérolémie (retenues comme objectifs thérapeutiques) ne sont pas des valeurs expérimentales définies par des essais d’intervention ni par des analyses coût-bénéfice. Elles ont été fixées consensuellement (avis d’experts et recommandations européennes et internationales actuelles) ». Or, les recommandations basées sur des avis d’experts présentent un niveau de preuve très inférieur à celles fondées sur des études cliniques. Par ailleurs, l’appel à l’expertise présente le risque de la mauvaise gestion de conflits d’intérêts.
Marcia Angell (2008N31) avait dévoilé le dessous des cartes :
On peut prendre pour exemple le groupe d’experts qui a recommandé de baisser drastiquement les valeurs dites « normales » de la lipoprotéine à basse densité [LDL cholestérol] : il s’agit du National Cholesterol Education Program, sponsorisé par les National Institutes of Health (NIH), avec le concours de l’American Heart Association et de l’American College of Cardiology. Il s’est avéré par la suite que 9 experts sur 10 avaient des liens financiers avec les firmes qui commercialisent des statines.
⇪ 6 – Les statines sont-elles sans danger ?

Un essai clinique est supposé confirmer ou infirmer une hypothèse primaireN49 qui ne peut être que la prédiction de l’efficacité d’un traitement médical. Il serait contraire à l’éthique (et à la loi) de conduire un essai visant à mesurer la toxicité d’un médicament : on ne peut pas empoisonner délibérément des sujets, même consentants ! Il s’ensuit que la toxicité, les effets indésirables des médicaments, ne sont connus qu’en marge d’essais mesurant leur efficacité, ou plus tard à partir de plaintes des patients auprès de leurs médecins prescripteurs. Un dispositif de pharmacovigilanceN65 a pour objet de faire remonter ces signalements aux autorités compétentes qui les transmettent aux fabricants d’un médicament, exigeant le cas échéant son retrait du marché.
⇪ Exclusion de participants
Dans le cadre d’une étude clinique, les sujets « prédisposés » à certains effets indésirables du médicament sont extraits de l’étude avant le tirage au sort. En général, on ne peut pas en estimer la proportion puisque les données cliniques brutes restent inaccessibles (secret industriel) même aux agences sanitaires. Sylvain Duval, du , écrit dans un commentaire de l’article de Dupagne D (2013A32) :
Les patients retenus pour l’essai, qui déjà ne sont plus représentatifs du tout d’un patient français, vont être re-sélectionnés, lors d’une période de “run in”. Cela permet de trier encore les fragiles, les non-observants, les bons répondeurs au médicament.
La proportion de sujets « intolérants » ainsi exclus de l’étude peut approcher les 20–30 % : elle était de 26 % dans l’étude British Heart Protection (HPS) sur la simvastatineN60 (Diamond DM & Ravnskov U, 2015A30, p. 4)… Ce qui permet de comprendre que les effets indésirables des statines ne sont en rien négligeables, bien que délibérément ignorés ou sous-évalués. Sylvain Duval (2013A32) signale aussi un biais fréquent sur les effets indésirables :
Pour tromper les médecins, le protocole va établir des règles extrêmes : le moindre petit incident sera utilisé pour une sortie de l’essai. Cela permet qu’il y ait presque autant d’effets secondaires dans le groupe « traitement » que dans le groupe « placebo » (ou contrôle).
Souvent même, comble de l’arnaque, on trouve même plus d’incidents dans le groupe « placebo ».
⇪ Description inadéquate des symptômes
Un exposé sur la mesure inadéquate des effets indésirables est présenté par Philippe Even (2015B7, p. 235–239). Il signale entre autres, lors des essais cliniques, une surveillance médicale insuffisante, souvent seulement par téléphone, avec des visites seulement tous les six mois, un recensement des complications par questionnaires écrits à cocher ou téléphoniques […] sans claire indication quantitative des symptômes, et des définitions disparates de ces effets secondaires ôtant toute valeur à la comparaison de différents essais. La procédure du double aveugle étant facile à contourner, comme nous l’avons vu — parce que le bilan lipidique permet de détecter les patients sous statine — ces incohérences servent à avantager les sujets traités et innocenter le médicament. Parfois même en comptabilisant plus d’effets indésirables dans le groupe placebo… Even jette un pavé dans la mare (2015B7, p. 239) :
On croit rêver ! 20 ou 30 % de complications sont la moitié obligeant à arrêter les traitements seraient aussi plus fréquentes sous placebo ! Qui peut y croire, sauf un cardiologue ?
Comment croire que 30 % des hommes et des femmes croisés dans la rue souffrent de mylagies, myopathies, troubles neurologiques, comme les patients sous placebo des essais cliniques, pourtant sélectionnés en rejetant ceux qui s’en plaignent ?
Marc Girard (2013A40), sur le même sujet :
On met ce qu’on veut dans une base informatique, depuis les morts rebaptisés en « perdus de vue » (ce qui est effectivement une façon de voir les choses…) aux effets indésirables graves « imputables au placebo » (mais oui !) : pour se recentrer sur les statines, que dire de ces patients (voire : de ces volontaires sains) sub-claquants avec des CPK [N66] à 15 000 ou plus codées « élévation enzymatique », « douleurs musculaires », voire « trouble de la fonction rénale » (ce qui est une autre façon de voir les choses) – bref de toutes ces manipulations qui permettent de conclure un développement catastrophique d’emblée en soutenant sans rire (et sans faire rire les autorités) qu’il y a eu MOINS de rhabdomyolyses [N67] sous produit actif que sous placebo ?
⇪ Un repentir de courte durée…
Le directeur de l’étude HPS, sir Rory Collins, une sommité en matière d’essais cliniques sur les statines, a reconnu en février 2015A10 que les experts avaient « négligé » d’étudier les effets indésirables des statines. Il admettait donc qu’il faudrait repartir des données brutes de tous les essais, et que le rapport bénéfices/risques devrait être corrigé à la lumière de cette révision.
Ce n’était toutefois qu’un vœu pieux… Un an plus tard, Collins publie dans The Lancet une méta-analyse cosignée par 27 auteurs (Collins R et al., 2016A19) — dont la plupart affichent des liens avec l’industrie pharmaceutique. Cette analyse vise à décrédibiliser les études concluant à un rapport bénéfices-risques défavorable des traitements par statines. L’article a fait l’objet de vives critiques par un groupe d’experts internationaux, parmi lesquels le cardiologue Aseem Malhotra (McDermott N, 2016A70) — voir l’article d’Aseem Malhotra et al. (2016A67).
La position de l’équipe de Rory Collins est singulière : Aseem Malhotra raconte dans un entretien (Rogan J, 2023N68 37:20) que, d’un côté il décrétait que les effets indésirables des statines touchaient moins de 1 % des patients, alors que, à la même époque, son département de l’Université d’Oxford a reçu 100 000 £ pour l’invention d’un test génétique StatinSmart qui détermine si un patient sous statines pourrait en souffrir d’effets secondaires. Ce test révélait que 29 % des patients pouvaient être victimes de ces effets ! Parmi les 25 à 50 % des patients souffrant de maladies cardiovasculaires qui arrêtent de prendre leurs médicaments à base de statines comme prescrits, 60 % citent les douleurs musculaires comme la raison principale de l’arrêt (Eurofins, 2016N69).
⇪ Pas de suivi à long terme
Une autre difficulté pour l’évaluation de la toxicité d’un médicament réside dans la durée d’exposition. Michel de Lorgeril (2015B6, p. 68–69) écrit :
La durée moyenne d’un essai clinique est de 4 ou 5 ans. Si cette durée peut suffire pour montrer l’efficacité (y compris transitoire) d’un médicament, elle est beaucoup trop brève pour faire apparaître un diabète ou un cancer. Il ne faudra pas moins de 10 années, voire 20 ans, pour qu’une différence significative apparaisse entre le groupe traité et le groupe placebo. […]
Seules l’épidémiologie d’observation [N70] et la pharmacovigilance [N65] permettent, après un certain temps, de conclure qu’un médicament a peu (ou pas) d’effets toxiques.
De Lorgeril poursuit (op.cit. p. 71–72) en expliquant pourquoi la toxicité des statines fait l’objet de vives controverses, notamment en ce qui concerne le risque de cancer. Le cholestérolN4 est un élément indispensable à notre métabolisme :
[A]voir un cholestérol élevé … est associé à une forme de protection contre différentes maladies. Or, après 2 ou 3 ans d’exposition à la statine, on proclame que les statines protègent de nombreuses maladies (du cancer par exemple). […]
Cette protection n’est qu’apparente, ce que l’on mesure en réalité c’est la protection dont les personnes bénéficient grâce à des décennies passées avec un cholestérol élevé.
Quelques années plus tard, la « protection » a disparu, selon de Lorgeril, et finalement, après 7, 8 ou 9 ans d’exposition à la statine, l’effet toxique de la statine peut pleinement s’exprimer aux yeux des épidémiologistes (2015B6, p. 73).
Les mêmes processus et biais d’interprétation s’appliquent à des troubles cognitifs et des maladies neurodégénératives comme Alzheimer et Parkinson (2015B6, p. 138–140).
⇪ C’est normal à votre âge !
Les statines étant le plus souvent prescrites à des personnes âgées, leurs effets indésirables, notamment les douleurs musculaires (jusqu’à 30 % des cas) qui peuvent aller de simples myalgiesN71 à des tendinitesN72 ou des douleurs articulaires, sont le plus souvent attribuées à « l’âge ». Selon Philippe Even (2015B7, p. 244) :
Ces complications sont probablement liées aux efforts de tension des cellules musculaires, à la fragilisation de leurs membranes et à l’inhibition de la voie du mévalonate [N73], avec pour conséquence l’altération de la synthèse de la créatine kinase [N66] et de l’ubiquinone [N74] et de la fourniture d’énergie.
Michael Leutner et al. (2019A66), faisant appel à une approche Big Data pour analyser les données de santé de plus de 7,9 millions d’Autrichiens de 2006 à 2007, ont montré qu’une dose quotidienne de plus de 20 mg de statines augmentait significativement l’incidence d’ostéoporose, même après avoir ajusté d’autres facteurs, comme l’âge, le surpoids et d’autres affections préexistantes. (À moins de 10 mg la tendance était inverse.)
Quand le lien avec la prescription de statine est reconnu, suite à l’interruption du traitement ou la diminution de son dosage, on accepte ces douleurs comme le prix à payer pour l’effet miraculeux de réduction du risque d’accident cardiovasculaire… Or de nombreux cas de rhabdomyolyse N67 (sévère nécrose des muscles se compliquant fréquemment d’insuffisance rénale) sont rapportés. Ils sont à l’origine de décès pour la plupart classés parmi les décès causés par une insuffisance rénale aiguë (de Lorgeril M, 2015B6, p. 84).
De manière générale, tout traitement entraînant des douleurs musculaires met en péril la mobilité du patient, indispensable à son maintien en bonne santé. Cette perte d’autonomie est fréquemment sous-estimée chez une personne « cardiaque » car elle est attribuée à son âge et son handicap cardiovasculaire plutôt qu’aux effets indésirables du traitement « protecteur ». Or la Société européenne de cardiologie reconnaît une prévalence de symptômes musculaires associés aux statines évaluée de 7 % à 29 % (Stroes ES et al., 2015A106).
La diminution de l’activité physique entraîne une fonte musculaire — une sarcopénieN75 — qui accentue l’invalidité et provoque des chutes souvent fatales chez les personnes âgées — voir mon article Vivre bien et longtemps.
Par manque d’exercice, la personne peut souffrir d’hypertension artérielle et de troubles du rythme, notamment la fibrillation auriculaireN76 qui est une cause fréquente d’accident vasculaire cérébral N3 (de Lorgeril M, 2015B6, p. 90, 143–144).
Un article de Béatrice A Golomb et Marcella A Evans (2008A44) passe en revue la littérature sur les effets indésirables des statines, mettant en évidence un mécanisme mitochondrial [N77] dans ces effets :
Des preuves convergentes appuient une fondation mitochondriale pour les effets indésirables musculaires associées aux statines, et des considérations théoriques et empiriques suggèrent que la dysfonction mitochondriale peut également sous-tendre de nombreux effets indésirables non musculaires des statines.
Les mitochondriesN77 sont des organitesN78 que l’on trouve dans le cytoplasmeN79 de toutes les cellules du corps, à l’exception des cellules sanguines (voir mon article Cancer - sources). Elles jouent un rôle vital de « poumons énergétiques » de nos cellules. Un effet indésirable des statines, encore peu documenté, est d’en accélérer le vieillissement.
Les maladies oculaires ne sont pas épargnées : dans l’étude de Jessica Leuschen et al. (2013A65) portant sur 46 249 patients de 30 à 85 ans, la consommation de statines a augmenté de 27 % l’incidence de cataractesN80. Le cas de la dégénérescence maculaire liée à l’âge (DMLAN81) reste ouvert, les conclusions des études étant divergentes (de Lorgeril M, 2015B6, p. 146–147).
Les effets se révélant tardivement peuvent être assimilés à une forme de démence sénile. Le député Claude Malhuret s’insurge : « Le jour où toutes ces personnes âgées qui consomment des statines et autres somnifères vont mourir d’un accident médicamenteux, personne ne va s’en occuper ou bien même s’en soucier. Elles seront mortes de vieillesse, comme tout le monde ! » (Lefèvre S, 2016A62). Ce constat a été repris par les médias grand public, bien que de manière sélective — et de facto favorable aux nouveaux médicaments — car on l’a réduit à une agitation de surface autour d’affaires médiatisées. Une médiatisation qui peut être à son tour sélective, voire manipulée pour servir de leurre, comme l’affirmait Marc Girard dans ses articles sur l’affaire du Mediator (Girard M, 2016A41). « Si l’on se rappelle bien, j’ai toujours interprété le pseudo-scandale Médiator comme une manipulation visant à retrouver la confiance des gens après l’immense scandale H1N1 : il est difficile de déterminer si Frachon a accepté son rôle par perversité ou par simple bêtise, mais il est clair que c’est avec délectation qu’elle s’y est prêtée. » (Girard M, 2019A42 note 34)
Au sujet des médicaments dangereux pour les personnes âgées, Girard (2011A39) ajoute :
Au constat des innombrables effets indésirables provoqués par des thérapeutiques d’intérêt plus qu’incertain, on s’empresse d’ajouter d’autres médicaments censément « correcteurs » et qui aggravent encore l’ensemble. […]
Pour un professionnel de santé, il est utile de savoir que, le plus souvent, une « déprescription » de statine chez un patient en soin palliatif améliore la qualité du temps qui lui reste à vivre (Kutner JS et al., 2015A60), selon le score de McGill (Cohen SR et al., 1995A18).
⇪ Maladies neurodégénératives
La question du déclenchement de neuropathiesN82 sous l’effet des statines reste ouverte (Lei Q et al., 2014A64) :
De plus en plus de preuves indiquent que les statines peuvent avoir des effets négatifs potentiels sur les maladies associées au système nerveux, y compris les myopathies, la neuropathie périphérique, l’hémorragie intracérébrale (HIC) et d’autres maladies du système nerveux central (déficience cognitive, dépression, troubles du sommeil, cauchemars et maux de tête).
Ce constat peut être étendu à des désordres cognitifs tels que la dépression, le suicide ou l’agressivité. Dans une méta-analyse, Muldoon MF et al. (1990A73) ont mesuré une augmentation significative des décès par accident, suicide ou actes violents des personnes traitées. Ils ont aussi observé le comportement plus agressif de singes chez qui on avait diminué le cholestérol.

L’étude rétrospective de XueMei Huang et al. (2015A51) a montré que :
[…] l’administration de statines était associée à une augmentation significative du risque de maladie de Parkinson (odd ratio = 2.39) [dans les 9 années] après ajustement sur le cholestérol global et autres facteurs de confusion. Réciproquement, un taux de cholestérol plus élevé était associé à un moindre risque de maladie de Parkinson après ajustement sur l’utilisation de statines et autres facteurs de confusion. […] Ces données contredisent l’hypothèse que les statines protègeraient contre la maladie de Parkinson.
D’autres exemples illustrant des troubles des systèmes nerveux central et périphérique sont décrits par David M. Diamond et Uffe Ravnskov (2015A30, p. 6–7) ainsi que Duane Graveline (2015A46, p. 8–9). Malheureusement, ces désordres sont classés dans de multiples catégories, ce qui permet d’afficher pour chacun une faible probabilité.
Fan Zhou et al. (2018A113) ont mesuré une association inverse entre les niveaux de cholestérol LDL‑C ou de cholestérol total et l’incidence de démence chez 3836 personnes âgées de plus de 50 ans. Autrement dit, la prise de statines augmenterait le risque de démence sénile. Leur article cite de nombreux travaux concordant avec ce résultat.
Les myopathies sont l’effet indésirable le plus fréquent chez les sujets traités avec des statines. David M. Diamond et Uffe Ravnskov écrivent (2015A30, p. 5–6) :
Cependant, dans presque tous les rapports des essais de statine il est dit que les détériorations de muscles se produisent chez moins de 1 % des sujets traités. Pour atteindre ce chiffre, les auteurs n’ont enregistré que des lésions musculaires chez les patients présentant une forte créatine kinase (CK) [N66], et une CK élevée est définie comme une valeur 10 fois supérieure à la limite supérieure normale dans deux déterminations successives. Une question pertinente est ce qui se passe après de nombreuses années de traitement par statine avec les muscles de personnes dont la CK est « seulement » neuf fois plus élevée que la normale ? De plus, les personnes atteintes de statines peuvent avoir des problèmes musculaires bien que leur CK soit normale […] et même les personnes sous statines sans symptômes peuvent avoir des signes microscopiques de lésions musculaires.
Des observations sur les effets indésirables des statines sont collectées sur un site de l’Université de CalifornieC10 construit dans le prolongement de l’étude randomisée Statin Effects Study sur la population de San Diego, avec le soutien financier des National Institutes of Health.
Les points essentiels et références importantes sur ce sujet ont été résumés par Donald W Miller (2015A72) dans le Journal of American Physicians and Surgeons et en français par Sylvain Duval sur le site du Formindep (2015A34).
⇪ La pomme et le médecin…

Des études randomiséesN38 menées avec rigueur ont conduit à des comparaisons amusantes — citées par Philippe Even (2015B7, p. 147) — entre l’efficacité des statines et celles d’ingrédients ordinaires d’un mode de vie sain : boire quelques verres d’eau ou manger une pomme. Adam Briggs et al. (2013A11) concluent par exemple, avec un sens britannique de l’humour au second degré :
Nous estimons que 5,2 millions de personnes sont admissibles au traitement par statine au Royaume-Uni, avec un supplément de 17,6 millions de personnes qui serait offert si elle était recommandée comme mesure de prévention primaire pour tous les adultes de plus de 50 ans. Plus d’adultes se traduirait par une réduction du nombre annuel de décès vasculaires de 9400 (intervalle de confiance à 95 % de 7000 à 12 500).
Le tableau 2 montre le régime quotidien de base et le régime alimentaire après l’inclusion d’une pomme par jour (en supposant que la consommation de calories ne soit pas modifiée). En appliquant ce régime à […] 70 % des 22 millions de personnes au Royaume-Uni âgées de plus de 50 ans, nous estimons le nombre annuel de décès vasculaires évités ou retardés à 8500 (intervalle de confiance à 95 % de 6200 à 10 800). On prévoit que la prescription de statines chez les personnes de plus de 50 ans entraîne 1200 cas de myopathie en excès, 200 cas de rhabdomyolyse [N67] et 12 300 diagnostics de diabète sucré [N57]. Le coût total du traitement par statines à partir du médicament seul est estimé à 180 millions de livres (217 millions d’euros, 295 millions de dollars) contre 260 millions de livres pour les pommes.
Les effets indésirables (myopathie etc.) des statines comptabilisés de manière fortuite ne sont donc que le « ver dans le fruit »… À méditer avec cette conclusion de Philippe Even (2015B7, p. 234) :
Leurs effets négatifs sont presque aussi peu visibles que les effets positifs qu’on leur prête. Pas de molécule dont il soit aussi difficile d’établir le rapport bénéfice-risque. Surtout quand on ne souhaite pas le faire.
La balle est dans le camp des médecins généralistes qui suivent les patients sous traitement et qui les connaissent, eux, leur environnement et leur histoire. Rien à attendre des cardiologues et des médecins hospitalo-universitaires. Seuls des généralistes, informés des risques, pourront poser les questions et y répondre. C’est de l’interaction d’un patient avec son environnement physique, mental et affectif qu’il s’agit. Ce ne sont pas les RCT [essais randomisés contrôlés] ni les hôpitaux qui y répondront. Il y a un bel avenir pour la recherche clinique des généralistes. À eux de le saisir, dans l’intérêt de leurs malades, à l’image de la thèse récente de Fr. Stambach, dirigée par Ph. Nicot sur les diabètes [N57] induits par les statines [2014A104]. Un exemple pour tous. En particulier pour les diabétologues, tel le Pr Grimaldi, et pour la HAS.
⇪ 7 – Statines et diabète
Dans l’étude JUPITER citée plus haut, l’effet diabétogène de la rosuvastatine (Crestor®N11) a été mis en évidence avec une telle intensité qu’il pourrait être la véritable raison de l’interruption anticipée de l’essai clinique. Nous avons vu que Cederberg H et al. (2015A14) avaient évalué à 46 % l’augmentation relative de l’incidence de diabètes de type 2N57 avec d’autres statines. Cette augmentation a été de 87 % dans l’étude rétrospective TRICARE sur 25 970 jeunes militaires américains, qui signale par ailleurs 2.5 fois plus de complications (Mansi I et al., 2015A69). La thèse de Frédérick Stambach (2014A104) est consacrée aux effets diabétogènes des statines. Il écrit dans sa conclusion :
À notre connaissance il n’y a eu aucune information délivrée aux professionnels de santé au sujet de ce nouvel effet indésirable, de la part des autorités sanitaires françaises. […] La découverte de cet effet secondaire après 25 ans de commercialisation (alors qu’il s’agit des molécules les plus vendues au monde), à partir de données qui n’avaient pas été publiées, interroge sur de potentiels conflits d’intérêts, et rappelle la nécessité d’avoir accès à toutes les données brutes. […] Une actualisation complète de l’information disponible pour les professionnels de santé et les patients serait nécessaire.
Il est édifiant d’énumérer les euphémismes dans une recommandation de l’Agence nationale de sécurité du médicament (ANSM, 2014A2) qui évoque sans la nommer une association entre la prise de statines et le déclenchement d’un diabèteN57 :
Certaines données suggèrent que les statines en tant que classe pharmacologique, augmenteraient la glycémie. Chez certains patients à risque élevé de survenue d’un diabète, les statines peuvent entraîner une hyperglycémie nécessitant l’instauration d’un traitement antidiabétique.
Cet argument est reproduit à l’identique par Jean-Luc Harousseau, président de la Haute autorité de santé, dans une communication que Philippe Even (2015B7, p. 261) qualifie d’ « aussi jésuite que courtelinesque ».
En 2012, les agences européennes et américaines du médicament ont reconnu un effet diabétogène des statines et ordonné aux fabricants de l’inscrire dans la liste des effets indésirables de ces médicaments, injonction sans effet à ce jour (septembre 2017)…
L’épidémie de diabète de type 2N57 qui sévit dans les pays industrialisés pourrait donc être en partie accentuée par la prescription systématique de statines. N’oublions pas que le diabète est un facteur de risque de pathologies rénales et oculaires (principale cause de cécité) ainsi que de cancer. De plus, on commence à voir apparaître dans les études épidémiologiques de populations traitées par statines d’autres pathologies favorisées par le diabète : les dépressions, les pathologies osseuses et les déclins cognitifs du vieillissement, voire les états démentiels (de Lorgeril M, 2015B6, p. 109).
En dépit de ces constats, de nombreux diabétologues — à l’instar de l’ANSMN84 en France — continuent à postuler que les statines seraient « protectrices » du diabète de type 2N57, s’appuyant entre autres sur l’étude multifactorielle STENO‑2 de Peter Gæde et al. (2003A47) qui couvrait seulement 160 sujets sur de multiples stratégies préventives, parmi lesquels l’arrêt du tabac, la pratique d’exercice et des conseils nutritionnels…
Les statines sont aussi responsables de syndromes prédiabétiques comme l’insulinorésistanceN85 (de Lorgeril M, 2015B6, p. 108), ainsi que d’hypogonadismeN86 (déficit en testostéroneN87) à la source de troubles de l’érection et de chute de libido chez les hommes mais aussi chez les femmes (op.cit., p. 117–118). En diminuant le cholestérol, elles peuvent aggraver une carence en vitamine D, avec pour conséquence une augmentation des facteurs de risques de nombreuses maladies chroniques (voir mon article Vitamine D).
Harumi Okuyama et al. (2015A82) exposent les mécanismes pharmacologiques qui, de leur point de vue, expliquent l’échec des statines en matière de prévention d’accidents cardiovasculaires :
Contrairement à la croyance actuelle que la réduction du cholestérol avec les statines diminue l’athérosclérose [N43], nous présentons une perspective que les statines peuvent provoquer la calcification des artères coronaires et agir comme des toxines mitochondriales [N77] qui altèrent la fonction musculaire dans le cœur et les vaisseaux sanguins par l’épuisement de la coenzyme Q10 [N89] et du Hème A [N90], perturbant la production d’ATP [N91]. Les statines inhibent la synthèse de la vitamine K2 [N92], le cofacteur de l’activation de la Gla-protéine [N93] matricielle qui à son tour protège les artères de la calcification. Les statines inhibent la biosynthèse des protéines contenant du sélénium, dont la glutathion peroxydase [N94] qui sert à supprimer le stress peroxydatif [N95]. Une altération de la biosynthèse de la sélénoprotéine [N96] peut être un facteur d’insuffisance cardiaque congestive, rappelant les cardiomyopathies [N97] dilatées observées avec une carence en sélénium. Ainsi, l’épidémie d’insuffisance cardiaque et d’athérosclérose qui sévit dans le monde moderne peut paradoxalement être aggravée par l’utilisation généralisée des statines. Nous proposons que les lignes directrices actuelles sur le traitement par statines soient réévaluées de façon critique.
⇪ 8 – Les statines protègent-elles du cancer ?
La détection directe d’un effet cancérigène (ou protecteur) des statines en expérimentation humaine exigerait un suivi sur plusieurs décennies qui n’est pas compatible avec des études cliniques menées sur 3 à 5 ans. Toutefois, l’analyse minutieuse des taux de mortalité par cancer dans certains essais cliniques de statines révèle une augmentation dans le groupe d’intervention (par rapport au groupe placebo) suggérant que ces patients ont pu être victimes de la progression d’une tumeur « dormante », sans manifestation clinique décelée avant l’essai.
Les pages 165 à 184 de l’ouvrage de Michel de Lorgeril (2015B6) révèlent les tentatives infructueuses de réhabilitation des médicaments anticholestérol (statines et ézétimibeN61) dans des méta-analyses qui falsifient l’interprétation des résultats des études citées. Nous avons déjà cité l’essai SHARP (2010A102 et 2011A7) combinant l’ézétimibe et la simvastatineN60. Comparés avec SEAS et IMPROVE-IT dans l’espoir de réhabiliter l’ézétimibe, les chiffres des trois essais signalent néanmoins une augmentation de la mortalité par cancer, en moins de 3 ans, chez les patients traités (de Lorgeril M, 2015B6, p. 170).
Quatre autres exemples d’essais cliniques de statines affichant dans leurs résultats une plus grande incidence de cancers chez les sujets traités sont analysés dans l’article de David M. Diamond et Uffe Ravnskov (2015A30, p. 4–5) : CARE, PROSPER, HPS, SEAS.
Au début des années 2000, des études affirmaient que « les statines diminuent le risque de cancer » (jusqu’à 50 % pour le cancer colorectal), mais l’impossibilité de reproduire cet effet a fait dire par la suite (toujours sur la base de méta-analyses) que « les statines n’ont pas d’effet sur le risque de cancer » (de Lorgeril M, 2015B6, p. 172 ; Coogan PF et al. 2002A21). L’étude observationnelle de Sune F Nielsen et al. (2012A75) portant sur la population du Danemark concluait à une légère association négative entre la prise de statines et l’incidence de cancer, mais C Klop et al. (2013A57) ont objecté :
Nielsen et ses collaborateurs ont rapporté que, dans le cadre d’une étude observationnelle, l’utilisation de statines chez des patients danois atteints de cancer était corrélée à une réduction de la mortalité liée au cancer. Cependant, une méta-analyse récente de 22 essais contrôlés randomisés et bien conduits, portant sur 66 582 patients ayant reçu des statines et 66 604 ayant reçu un placebo, a montré que le traitement par la statine pendant 5 ans n’avait aucun effet sur le risque de décès par cancer (risque relatif, 1.00 ; intervalle de confiance à 95 %, 0.93 à 1.08). Les études observationnelles montrent étonnamment souvent que les statines ont des effets bénéfiques sur divers effets sur la santé, contrairement aux essais randomisés et contrôlés. De tels écarts entre les études d’observation et les essais contrôlés randomisés ont également été observés pour les études sur les fractures et la pneumonie. Les biais observés par les utilisateurs en bonne santé dans les études d’observation peuvent expliquer cette différence. Une enquête menée auprès de médecins généralistes britanniques a montré qu’ils sous-prescrivent sélectivement les statines aux fumeurs, en raison de leur mode de vie malsain. Le tabagisme est un facteur de risque important de fracture, de pneumonie et de décès lié au cancer. Cela peut avoir conduit à une association inverse entre l’utilisation de statines et le risque de décès lié au cancer dans l’étude observationnelle de Nielsen et ses collègues. L’absence d’effet dose-réponse dans leur étude conforte cette hypothèse.
Des essais cliniques continuent par contre à signaler une augmentation de la mortalité par cancer (de Lorgeril M, 2015B6, p. 174) :
Le premier essai testant une statine (la pravastatine) et qui ait révélé son effet cancérigène est l’essai CARE. Il y eut plus de cancers du sein [4 %] dans le groupe traité avec la statine. Les investigateurs prétendirent que c’était un effet du hasard et que d’ailleurs d’autres essais en cours (avec la même statine) n’émettaient pas le même signal. Les autres essais en cours avaient inclus très peu de femmes et n’avaient donc aucune chance de détecter un « signal cancer » du sein ! La ficelle est si grosse qu’on se demande comment la communauté médicale a pu avaler de telles couleuvres…
[…] Depuis CARE, une femme ayant eu un cancer du sein ne sera jamais recrutée dans un essai clinique testant des médicaments anticholestérol ; même si elle est considérée guérie.
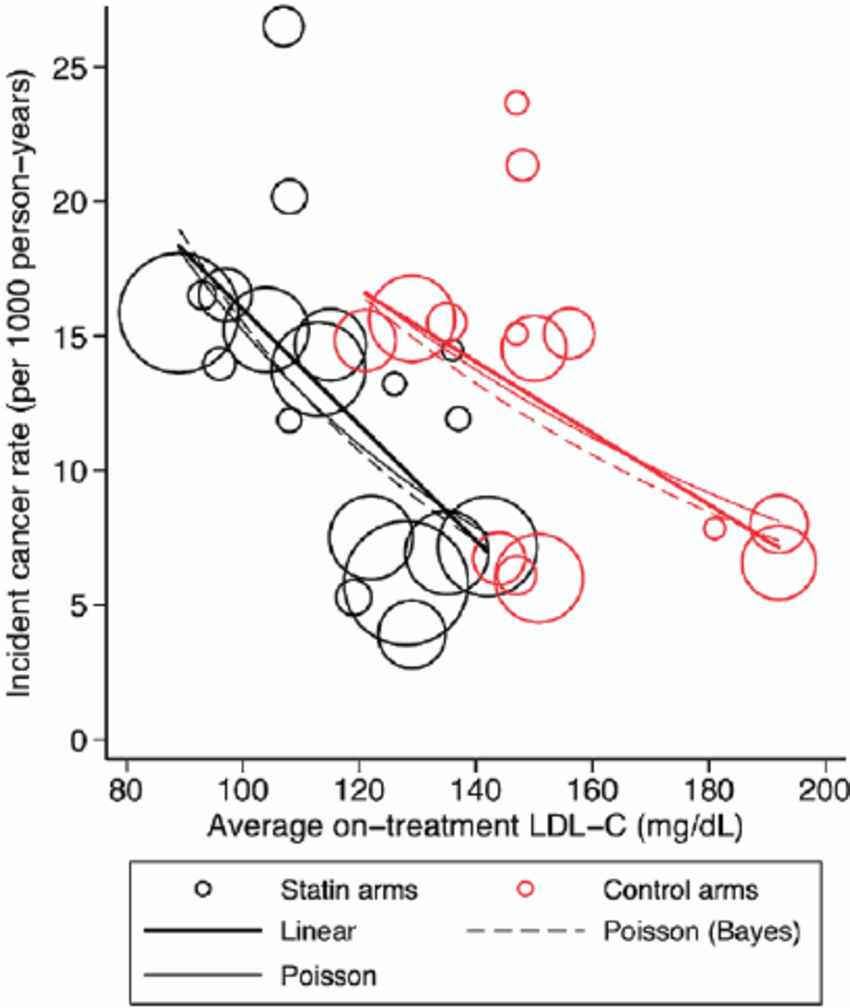
Source : Alsheikh-Ali, AA et al. (2008A4)
La méta-analyse de Alsheikh-Ali AA et al. (2008A4) mérite une attention particulière pour son interprétation des résultats (voir figure ci-contre). J’emprunte quelques commentaires à de Lorgeril M (2015B6, p. 177–179).
Les chercheurs ont affiché la relation entre le taux de lipoprotéines LDL‑C (le « mauvais » cholestérol) et l’incidence de cancers dans 15 essais cliniques de statines. Les aires des cercles correspondent aux nombres de participants et reflètent donc l’importance relative de chaque essai. Les résultats pour les patients sous statine sont affichés en noir, et ceux des groupes placebo en rouge. Il est clair que, dans les deux cas, un plus grand taux de LDL‑C correspond à une moindre incidence de cancers — autrement dit, le « mauvais cholestérol » est protecteur du cancer, que l’on soit ou non sous statine, ce qui est matérialisé en moyenne par l’inclinaison des droites noire et rouge. Mais les auteurs raisonnent différemment : puisque la courbe du groupe statine (en noir) n’est pas déplacée vers le haut par rapport à celle du groupe placebo (en rouge), ils se contentent d’écrire que les statines « n’augmentent pas le risque de cancer »…
Chacun voit midi à sa porte ! Car l’effet cancérigène n’avait quasiment aucune chance d’être mesuré dans des études cliniques conduites sur 0.9 à 6.1 annéesA4, p. 1143. Dans une version antérieure de cette analyse (2007A3), les auteurs avaient eu le courage de conclure que les bénéfices cardiovasculaires de l’abaissement du taux de LDL‑C [par des statines] sont en partie annulés par l’augmentation de risque de cancer.
L’effet cancérigène des traitements visant à abaisser le cholestérol apparaît clairement, et de manière inquiétante, dans les études récentes correspondant à une exposition aux statines pendant plus d’une dizaine d’années. De Lorgeril M (2015B6, p. 181–183) cite les publications de McDougall JA et al. (2013A71) pour deux formes de cancer du sein, Nordström T et al. (2015A80) pour le cancer (grave) de la prostate, et Hung SH et al. (2014A52) pour le cancer de la thyroïde (chez les femmes seulement). Sur une période de dix ans, le risque de cancer du sein est presque doublé, celui de grave cancer de la prostate augmenté de 25 % en cinq ans, et celui de cancer de la thyroïde chez les femmes de 43 %.
⇪ 9 – Effets pléiotropes des statines
Effet pléiotropeN98 d’un médicament : qui se manifeste indépendamment de son principal effet.
Les recommandations récentes de l’American Heart Association (2013C2) préconisent de ne plus tenir compte des taux de cholestérol pour la prescription de statines ; elle devrait se faire au cas par cas, certaines statines correspondant mieux à certains profils cliniques :
Pour les patients prenant des statines, les recommandations disent qu’ils n’ont plus besoin de cibler leur cholestérol LDL vers un taux spécifique — une différence importante avec la façon dont les médecins ont traité le cholestérol pendant des années. Alors que la recherche montre clairement que l’abaissement des LDL diminue le risque de crise cardiaque et d’accident vasculaire cérébral, il n’y a aucune preuve pour soutenir qu’une valeur de cible est la meilleure.
Le message implicite est que les statines exerceraient un effet protecteur des maladies cardiovasculaires quelle que soit la diminution du LDL‑C. On parle donc ici d’effets pléiotropes.
On reconnaît ainsi aux statines un effet anti-inflammatoire, invoquant une explication particulière du mécanisme de l’athérosclérose. Donald W Miller (2015A72 p. 55) écrit à ce sujet :
Russell a démontré que l’athérosclérose [N43] est un processus inflammatoire chronique et fibroprolifératif, qui n’est pas fondamentalement différent de celui qu’on retrouve dans la cirrhose, l’arthrite rhumatoïde et la pancréatite chronique. Le faible bénéfice conféré par les statines en termes de maladie cardiovasculaire athérosclérotique est dû à leurs effets anti-inflammatoires non hypolipidémiants. Parmi ceux-ci, on retrouve en particulier leur capacité à supprimer le facteur nucléaire kappa B (NF-κBN99), un facteur de transcription consistant à intensifier la réponse inflammatoire.
Ankur Rohilla et al. désignent les effets pléiotropes comme un boulevard pour la cardioprotection en citant un grand nombre de travaux (2016A97)… Un problème majeur est que ces études mettent en exergue des effets marginaux de protection sans vérifier l’incidence sur l’espérance de vie des patients, ce qui était le plus attendu en matière de cardioprotection. Elles tiennent en effet pour acquis que les statines sont efficaces pour diminuer la mortalité générale. D’autre part, nous l’avons vu, elles font l’impasse sur les effets indésirables de ces mêmes statines.
L’utilisation à large échelle d’un médicament détourné de son utilisation initiale pour ses seuls effets pléiotropes a dramatiquement montré ses limites dans l’affaire du MediatorN100. On peut s’attendre, au niveau d’utilisation des statines (plus de 10 % des Français), à un scandale sanitaire d’une ampleur bien plus considérable.
Prenons l’exemple d’une statine (pravastatine, N10) qui m’a été prescrite malgré un taux de LDL‑C inférieur à 1.2 g/l le jour de la prescription. Le seul essai de cette statine mené à grande échelle par un laboratoire indépendant (ALLHAT-LLT, 2002A1) ne constatait aucune différence significative entre la pravastatine et les groupes de soins habituels dans la mortalité toutes causes confondues ou la mortalité par maladie cardiovasculaire incluant mortelle et non mortelle.
Justification qui m’a été donnée : les effets pléiotropes de ce médicament. Or, ceux-ci n’ont été détectés qu’en expérimentation animale — rats et lapins (Rohilla A et al., 2016.A97) — et donc en l’absence d’essai randomisé contrôlé avec groupe témoin sur des humains… Alors que ses effets secondaires sont considérables. Selon les sources officielles (Cerner Multum et Bristol-Myers Squibb, C3) : douleurs musculaires (jusqu’à 24.9 % des patients), nausées et vomissements (jusqu’à 10.5 %), douleurs dans la poitrine (jusqu’à 10 %), maux de tête et vertiges (jusqu’à 10 %), infection des voies respiratoires (jusqu’à 21.2 %), dermatites (jusqu’à 10 %), angine de poitrine (jusqu’à 10 %), vision troublée (jusqu’à 10 %), insomnie, anxiété et dépression (jusqu’à 10 %), infections du canal urinaire (jusqu’à 10 %) etc.
La notice de l’ANSMC1 reproduit cette liste d’effets indésirables, mais sans les taux d’incidence, avec pour tout avertissement : « La plupart des effets indésirables rapportés sont peu fréquents » !
Il y a quand même une bonne nouvelle… si l’on peut dire : cette statine n’est pas de celles les plus à risque de déclenchement de diabète de type 2N57 — augmentation relative de risque jusqu’à 46 % pour d’autres, selon Cederberg H et al. (2015A14).
Les marchands de statines ne baissent jamais la garde, car récemment la presse s’est fait largement écho d’une « prolongation » de l’étude WOSCOP (No authors, 1996A78) sur la pravastatine qui conclut qu’en prévention primaire, les statines réduisent la mortalité coronarienne de 28 % chez les hommes ayant un taux élevé de LDL-cholestérolN101. À noter que le scoop sur cette « étude récente » sent le réchauffé car elle avait été publiée trois ans plus tôt (O’Riordan M, 2014A81)…
Voici un commentaire de Dr L. Vercoustre publié sur Le Quotidien du Médecin (09/09/2017) :
Encore une intox au sujet des statines. Voilà qu’on exhume une vieille étude. Je rappelle que l’étude WOSCOP date de 1991. C’est la seule étude qui a montré l’efficacité des statines sur la mortalité cardiovasculaire.
Cette étude avait été réalisée bien avant l’affaire du VIOXX. Après l’épisode VIOXX, plus aucune ne montrera l’efficacité des statines pour diminuer la mortalité CV, de nouvelles règles de contrôle des études ayant été imposées après l’affaire du VIOXX. L’étude WOSCOP avait été sévèrement critiquée.
Environ 30 % des patients inclus dans l’essai ont été perdus de vue. Les taux cumulatifs de retrait du traitement dans les groupes placebo et Pravastatine étaient respectivement de 14,9 % et 15,5 % respectivement la 1ère année ; à 19,1 % et 19,4 % la 2e année ; 22,5 % et 22,7 % la 3e année ; 25,2 % et 24,7 % la 4e année puis 30,8 % et 29,6 % la 5e année. Sans que les auteurs de l’étude puissent fournir une explication convaincante. Ceci est un biais majeur qui diminue fortement l’intérêt de cette étude car en sciences, tout ce qui n’est pas expliqué (même par un début de piste) est hautement suspect.
Par ailleurs depuis l’étude WOSCOP d’autres études relatent une augmentation des cas de cancers dus aux statines en général, et à la pravastatine en particulier… Notamment des cancers de la prostate.
Autre effet secondaire indésirable de l’étude WOSCOP, une augmentation de plus de 43 % dans le groupe pravastatine des décès par AVC…
Michel de Lorgeril commente sur son blog :
Cette étude publiée dans la revue officielle de la Société Américaine de Cardiologie (AHA), cosignée par de « prestigieux » auteurs et que personne dans la Nomenklatura universitaire ici et ailleurs ne conteste est un magnifique témoignage… de ce que nous savions déjà : ils ne comprennent rien aux sciences médicales, en particulier à l’essai clinique, pierre angulaire des sciences médicales car seul moyen de démontrer des causalités.
Ci-dessous la réponse que j’ai faite récemment […]
Such a study is just stupid and non scientific.
As you know, when you decide to test a medical drug, you must organise a randomised trial (RCT).
Any RCT is based on a primary hypothesis. What is it ?
It is the calculation of the sample size and duration of follow-up needed to test a given reduction of the risk of a well defined endpoint.
The primary hypothesis is like a horse race protocol. Before starting, the jockeys must know the starting and the finish lines in the hippodrome and the number of laps to go.
Once the finish line has been crossed by the winner, the race is over, the horses should go and rest… And the public go to the the counter to get the winnings of their bet…
Imagine that some jockeys decide to keep on running… until the next day or week.
Why not ? Would you take them seriously ?
The only difference between the horse race and a RCT is that in principle there are several horses whereas in a RCT there are two groups only, one being the placebo.
Please put Woscop in the trash…
Except if you need some (non scientific) data for your students’ thesis… oops !
This is the today medical science !
⇪ 10 – Peut-on « stabiliser » la plaque d’athérosclérose ?
Au chapitre des effets pléiotropes de la rosuvastatineN11, on pourrait verser l’essai clinique ASTEROID (Chhatriwalla AK et al., 2006A16) selon lequel l’administration d’une forte dose (40 mg/jour) de cette statine pendant deux ans aurait fait régresser la plaque d’athéroscléroseN43… si cet essai avait été conduit en double aveugle, condition minimale pour lui accorder la moindre crédibilité !
Ce résultat est d’ailleurs contradictoire de ceux d’autres études (Puri R et al., 2015A90) qui concluent à l’inverse que les statines contribuent à une calcification de la plaque d’athérosclérose — élégamment baptisée « stabilisation ».
L’article de Shaw, LJ et a. (2015A103) interroge la contradiction entre calcification et régression, soulignant que ces études n’ont pas formellement prouvé que la calcification induite par l’administration de statines conduirait à une diminution sur le long terme du risque cardiovasculaire.
La calcification des artères coronaires est au contraire un prédicteur de maladies cardiovasculaires : dans l’étude multi-ethnique de Detrano R et al (2008A28), un doublement du score calciqueN103 (CAC) mesuré par tomodensitométrie (CT scanN104) est associé à une augmentation de 15 à 35 % du risque d’accident coronaire grave, et 18 à 39 % de celui d’un accident coronaire en général. L’étude de Valenti V et al. (2015A110) confirme qu’un score calcique de 0 offre le meilleur pronostic de survie à 15 ans, que le sujet soit à faible ou à haut risque d’accident cardiovasculaire. Par contre, un score calcique supérieur à 100 (athérome coronaire débutant) multiplie par plus de 3 le risque de décès pendant cette période, et plus de 7 pour un score supérieur à 1000 (Valenti V et al., 2015A110, table 3). Selon Cho I et al. (2017A17), le pronostic de maladie coronarienne peut être évalué par le score calcique bien avant l’apparition des lésions sténosantes hémodynamiquement significatives, qui ne sont qu’une étape de la maladie parmi bien d’autres. L’étude multi-ethnique de Malik S et al. (2017N105) montre que le score calcique joue aussi à lui seul un rôle significatif dans la prédiction d’accidents cardiovasculaires chez des personnes souffrant de diabète de type 2N57 ou plus généralement d’affections catégorisées dans le syndrome métaboliqueN106.
Le score calcique coronaire est supérieur aux anomalies lipidiques pour évaluer le risque d’événements cardiovasculairesN103. L’observation de deux effets contradictoires des statines a donné lieu à une interprétation délirante des marchands de statines, signalée sur le blog de Michel de Lorgeril (2015A25) et qu’il résume ainsi : « Le calcium dans les artères est “très bien” puisque ce sont les statines qui font le job ! »
La valeur prédictive du score calcique pour le risque d’accident cardiovasculaire est toutefois controversée. Un résumé de cette controverse est exposé par Dr Michael Eades (2022N107) qui a lui-même longuement pratiqué le CT-scan :
J’ai appris que le CAC, tel qu’il est calculé actuellement, n’était pas une mesure réelle du risque de crise cardiaque. À l’époque où je travaillais sur le chapitre consacré à la paléopathologie dans Protein Power, je suis tombé sur un article de George V. Mann [1972A68] qui avait pratiqué de nombreuses autopsies sur les membres des Masaïs, des bergers nomades d’Afrique dont le régime est principalement composé de viande, de lait et de sang. En étudiant les Masaïs, Mann a constaté qu’ils n’avaient pratiquement aucune incidence de maladies cardiaques ou de crises cardiaques. Mais les autopsies ont montré qu’ils avaient une tonne de calcium dans leurs artères coronaires remplies de plaques.
Il s’avère que le calcium stabilise la plaque. Il existe deux types de plaque : stable et instable. La plaque instable est celle qui a tendance à se rompre, à former un caillot et à provoquer une crise cardiaque. La plaque stable est, eh bien, stable. Elle semble causer très peu de problèmes, voire aucun. […]
Si une personne présente un grand volume de plaque, mais très peu de calcium, cela signifie que la plaque pourrait bien être instable. Et susceptible de se rompre, de former un caillot et d’entraîner une crise cardiaque. Il est donc important de prendre en considération le volume de la plaque.
Michael Eades cite ensuite Criqui MH et al. (2014N108) :
Les auteurs de cet article ont étudié une autre façon de stratifier les personnes dont le CAC du scan était positif. Leur formule fait intervenir à la fois le volume de la plaque et la densité. Le problème, c’est que ce qu’on lit sur un rapport CAC indique généralement la surface de la plaque et la densité. Le rapport est issu d’un scanner bidimensionnel, et le volume est un nombre tridimensionnel. Pour calculer le volume, vous devez disposer d’une autre dimension, que vous pouvez obtenir auprès des personnes qui font fonctionner le scanner. La plupart des scanners utilisent une tranche de 2.5 mm ou de 3 mm, il suffit donc de connaître la taille de la tranche pour pouvoir calculer le volume.
Une fois que vous avez le volume et le score, vous pouvez générer un autre nombre, qui vous place dans une catégorie de risque. La catégorie de risque a été déterminée en suivant d’innombrables patients dont le score était connu et en observant combien d’entre eux ont effectivement eu une crise cardiaque.
En examinant des patients qui pratiquaient un régime faible en glucides, Michael Eades a remarqué que leur score CAC selon le calcul habituel était élevé parce que le volume de plaque avait diminué, de sorte que la densité de calcium avait augmenté. Le risque calculé selon la stratification de MH Criqui et al. était par contre diminué pour ces patients.
Dans mon article Overdose d’exercice ➜ danger, j’ai signalé que la calcification des artères pouvait aussi toucher les marathoniens confirmés, comme cela a été observé par Möhlenkamp S et al. (2008A74) sur des sujets âgés de plus de 50 ans. Chez les athlètes pratiquant de l’entraînement de haute intensité, un durcissement des parois des artères a pu être observé (Otsuki T et al., 2007A83), mais ils peuvent l’éviter en augmentant progressivement l’intensité de l’effort sans agir sur le volume (Casey DP, 2007A13), ce qui correspond à une bonne pratique de réhabilitation cardiovasculaire, voir mon article Entraînement fractionné de haute intensité – pratique.
⇪ 11 – Que valent les nouveaux médicaments anticholestérol ?
De nouveaux médicaments voient le jour en remplacement des statines, en partie pour satisfaire les patients qui se plaignent d’effets indésirables de ces dernières, mais aussi pour assurer les profits de l’industrie à mesure que les molécules existantes tombent dans le domaine public.
Je laisse au lecteur le loisir de découvrir dans de Lorgeril M (2015B6, p. 192–211) les arcanes des médicaments injectables anti-PCSK9N109, Evolocumab® et Alirocumab®, ainsi que des essais cliniques ODYSSEY puis OSLER qui ont servi à leur évaluation. Pour le premier (Robinson JG et al., 2015A96), les auteurs se sont livrés à une analyse a posterioriN110 plutôt que de formuler une hypothèse a priori, concluant à une réduction de 50 % du risque de complications cardiovasculaires dans le groupe traité à l’Alirocumab®. Quant au second (Sabatine MS et al., 2015A98), mené à la hâte car Amgen cherchait à rattraper Sanofi, il a été conduit sans procédure de double aveugle, et le groupe témoin ne recevant pas de placebo, ce qui lui ôte toute crédibilité.
Une présentation détaillée de nouveaux médicaments anticholestérol se trouve dans Even P (2015B7, p. 271–289) : anti-PCSK9N109, anti-NPC1N111 et Darapladib®N112. Sur ce dernier — un inhibiteur de la Lp-PLA2N113 — les études génétiques se sont révélées contradictoires et les essais cliniques pilotés par GSK (SOLID-TIMI.52 et STABILITY) ont abouti à des échecs. Philippe Even conclut (2015B7, p. 286) : « Telle est la triste histoire de thérapeutiques “ciblées” contre un cholestérol innocent… »
Dans les essais ODYSSEY et OSLER, la fréquence des effets indésirables est alarmante (de Lorgeril M, 2015B6, p. 196–197), qui vont de syndromes musculaires à des AVC (pour ODYSSEY), en passant par des troubles neurocognitifs et oculaires (pour les deux). Après les avoir décrits et commentés, Philippe Even (2015B7, p. 288–289) conclut :
Ainsi, après avoir conquis une grande part des traitements curatifs courts, sur quelques mois, en particulier en rhumatologie et oncologie, et déjà coûté des milliards d’euros […], voici que les monoclonaux à l’équivalent de 50 euros/jour s’attaquent au marché bien plus lucratif des traitements préventifs au long cours des accidents cardiovasculaires, malgré des complications parfois très graves. Plus qu’un non-sens scientifique, ce serait — et ce sera probablement — un scandale de santé publique de plus et le naufrage économique, comme programmé, de notre système de protection sociale et d’assurance maladie.
Une méta-analyse de 14 essais cliniques associant aux traitements par statines l’ézétimibeN61 ou des anti-PCSK9N109 (Khan SF et al., 2022A55) montre une légère réduction des infarctus du myocarde et des AVC, sans aucun effet sur la mortalité cardiovasculaire ni la mortalité pour toutes causes : les décès étaient plus nombreux dans les groupes traités que dans le groupe placebo. La Food and Drug Administration, aux USA, a refusé que l’entreprise Merck déclare que réduire le cholestérol avec les médicaments Zetia et Vytorin — respectivement de l’ézétimibeN61 et sa combinaison avec la simvastatineN60 — diminuerait les risques d’accident cardiovasculaires et d’AVC (Reuters, 2016C8). Le Gouvernement du Canada a émis un avis (27 mars 2024A45) :
Ezetrol (ézétimibe) peut causer des effets indésirables graves, notamment des lésions hépatiques d’origine médicamenteuse et des réactions indésirables cutanées sévères, telles que le syndrome de Stevens-Johnson (SSJ), la nécrolyse épidermique toxique (NET) et un syndrome de réaction médicamenteuse avec éosinophilie et symptômes systémiques (syndrome de DRESS).
On peut douter de l’utilité de tout nouveau médicament visant à diminuer le cholestérol, dans la mesure où les travaux récents contribuent à prouver qu’un faible taux de cholestérol serait associé à une augmentation de risque de maladies chroniques — ou, de manière équivalente, que le cholestérol serait protecteur de ces mêmes maladies. En marge d’une étude sur l’Evacetrapib®N114, l’auteur Stephen Nicholls constatait : « Au terme de cet essai, nous cherchons à comprendre comment un médicament qui paraît faire tout ce qui est bien en termes de taux sanguin de cholestérol ne réussit pas à réduire les événements cliniques » (Communiqué de presse, Casteel B, 2016A20).
Un résultat attendu pour les anti-PCSK9N109 était le traitement des hypercholestérolémies familialesN115 que l’on rencontre dans une naissance par million pour les formes homozygotes, et une sur 500 pour les formes hétérozygotes. On leur reconnaît des effets biologiques [réduction du LDL‑C], mais aucune étude n’a mesuré d’éventuels effets sur les dépôts lipidiques et les accidents vasculaires (Even P, 2015B7, p. 281). Les cinq essais cliniques ODYSSEY sur l’Alirocumab n’ont donné aucun résultat significatif dans le traitement des hypercholestérolémies familiales (Ravnskov U et al., 2018A93) — voir à ce sujet la page Pourquoi diminuer le cholestérol ?
⇪ 12 – Alors, que faire ?
À ce stade de la lecture, je peux supposer que le prescripteur ou consommateur de statines et autres médicaments anticholestérol est prévenu de la dangerosité de ces traitements et de leur incapacité à diminuer les risques de décès pour toute cause, y compris les infarctus du myocarde et les AVC. La question subsidiaire est celle de l’existence d’autres moyens de protection en prévention primaire ou secondaire.
Ces moyens font l’objet de mon article Soigner ses artères.
On ne peut que déplorer l’immense investissement financier et humain — aux frais des contribuables et des patients-consommateurs — dans une soixantaine d’essais cliniques visant à prouver l’efficacité des statines en prévention des accidents cardiovasculaires. Philippe Even écrit (2015B7, p. 151) écrit : « Aucune des grandes thérapeutiques du passé n’a donné lieu à une telle débauche de RCT [essais randomisés contrôlés] pendant tant d’années […] »
Il me semble que, si seulement une partie infime de cette manne avait été attribuée à des travaux visant à réduire ou éliminer la plaque d’athéroscléroseN43, la mortalité par accident cardiovasculaire aurait encore plus régressé, sans pour cela induire une morbidité liée aux effets indésirables des médicaments, et faussement attribuée à « l’âge ».
Dans son article Homéopathie, médecine et anti-médecine (2019A111), Laurent Vercoustre prend acte de la décision du déremboursement des médicaments homéopathiques, en France, sur la base d’absence de preuves de leur efficacité. Il suggère que la Haute Autorité de Santé démontre la même intransigeance à l’égard d’une classe de médicaments sur laquelle pèse depuis déjà longtemps une redoutable suspicion [… les] statines. […] Le montant des remboursements s’élevant à 1,2 milliard d’euros par an. Comparé aux statines, le coût de l’homéopathie, autour de 100 millions d’euros, est une goutte d’eau. C’est effectivement la classe de médicaments contribuant le plus à la croissance du marché pharmaceutique.
La focalisation actuelle sur un contrôle médicamenteux des taux de lipides et autres paramètres vitaux masque l’urgence d’une prise de conscience, au niveau individuel et institutionnel, des véritables facteurs de maintien en bonne santé. Ceci concerne notamment les enfants. Interrogés sur la pertinence de traitement par statines de l’hypercholestérolimie familialeN115, Sarah de Ferranti et David S. Ludwig ont déclaré (2008A22) :
La couverture médiatique intense de la nouvelle politique des statines a peut-être éclairé le profond décalage culturel entre notre volonté de traiter la maladie avec des médicaments, et notre réticence à mettre en place des mesures préventives de santé publique. Ces mesures incluront la réglementation de la commercialisation des aliments pour les enfants, l’amélioration de la qualité de la nutrition à l’école, la promotion de l’activité physique à l’école et ailleurs, et le financement de programmes de prévention et de traitement de l’obésité. Si les recommandations de l’American Academy of Pediatrics ont aidé à mettre en lumière cette déconnexion, alors leur plus grand effet ne peut pas être sur les enfants qui recevront un traitement pharmacologique pour l’hypercholestérolémie, mais plutôt sur les adultes qui sont responsables du monde dans lequel nos enfants vivent.
Les fabricants de statines n’ont pas baissé les bras (signalé sur cholesterol-statine.fr) : AstraZeneca a financé une étude prospective mesurant l’efficacité d’une application Web « pour déterminer l’éligibilité et l’accès à une statine sans ordonnance » (Nissen SE et al., 2024A76). Cette méthode est incontestablement « efficace » puisqu’on affiche une réduction de 35.5 % du taux de LDL‑C après six mois, chez des patients d’âge moyen 63 ans ayant un taux initial moyen de 1.4 g/l. Efficace, donc, pour « diminuer le cholestérol », mais rien n’est dit du gain/perte en termes d’espérance de vie !
⇪ Références
⇪ ✓ Articles
🔵 Notes pour la version papier :
- Les identifiants de liens permettent d’atteindre facilement les pages web auxquelles ils font référence.
- Pour visiter « 0bim », entrer dans un navigateur l’adresse « https://leti.lt/0bim ».
- On peut aussi consulter le serveur de liens https://leti.lt/liens et la liste des pages cibles https://leti.lt/liste.
- A1 · ksap · ALLHAT Collaborative Research Group (2002). Major Outcomes in Moderately Hypercholesterolemic, Hypertensive Patients Randomized to Pravastatin vs Usual Care. JAMA, 288, 23 : 2998–3007.
- A2 · 3q2q · ANSM (2014). Statines et risque de diabète : le rapport bénéfice/risque reste toujours positif. Point d’Information.
- A3 · t3m3 · Alsheikh-Ali, AA et al. (2007). Effect of the Magnitude of Lipid Lowering on Risk of Elevated Liver Enzymes, Rhabdomyolysis, and Cancer. Insights From Large Randomized Statin Trials. Journal of the American College of Cardiology 50, 5 : 409–418.
- A4 · 3w92 · Alsheikh-Ali, AA et al. (2008). Statins, low-density lipoprotein cholesterol, and risk of cancer. Journal of the American College of Cardiology, 52, 14 : 1141–1147.
- A5 · xqdz · Aubry, E (2017). Cholestérol : entretien avec Dominique Dupagne. Vidéo, Arte, le 28/11/2017.
- A6 · 1w5b · Baigent, C et al. (2005). Efficacy and safety of cholesterol-lowering treatment : prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet, 366, 9493:1 267‑1278.
- A7 · ugag · Baigent, C et al. (2011). The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet, 377, 9784:2181–92.
- A8 · na9g · Berthold, HK et al. (2011). Lipid lowering in patients with chronic kidney disease : a SHARP turn in the wrong direction ? Eur J Cardiovasc Prev Rehabil., 18, 6 : 858–861.
- A9 · c6hw · Bollapragada, SS et al. (2007). Review of new regulations for the conduct of clinical trials of investigational medicinal products. BJOG, July.
- A10 · piwr · Borland, S (2015). Statins expert to put drugs’ side-effects under the microscope : Professor to study thousands of patient records to discover how many may have suffered issues. MailOnline, 16 February.
- A11 · 5fay · Briggs, ADM et al. (2013). A statin a day keeps the doctor away : comparative proverb assessment modelling study. BMJ, 347 : f7267.
- A12 · x0rn · Byrne, P et al. (2022). Evaluating the Association Between Low-Density Lipoprotein Cholesterol Reduction and Relative and Absolute Effects of Statin Treatment : A Systematic Review and Meta-analysis. JAMA Intern Med. May 1, 182, 5 : 474–481. doi:10.1001/jamainternmed.2022.0134
- A13 · r6os · Casey DP (2007). Progressive resistance training without volume increases does not alter arterial stiffness and aortic wave reflection. Exp Biol Med (Maywood), 232, 9 : 1228–1235.
- A14 · vod1 · Cederberg, H et al. (2015). Increased risk of diabetes with statin treatment is associated with impaired insulin sensitivity and insulin secretion : a 6 year follow-up study of the METSIM cohort. Diabetologia, 58 : 1109.
- A15 · o6a5 · Chen, T et al. (2019). Comparison of Clinical Trial Changes in Primary Outcome and Reported Intervention Effect Size Between Trial Registration and Publication. JAMA Netw Open 2, 7 : e197242.
- A16 · o3vz · Chhatriwalla, AK et al. (2006). The ASTEROID trial : coronary plaque regression with high-dose statin therapy. Future Cardiol., 2, 6 : 651–654.
- A17 · 46os · Cho, I et al. (2017). Prognostic implications of coronary artery calcium in the absence of coronary artery luminal narrowing. Atherosclerosis, 262 : 185–190.
- A18 · wh8k · Cohen, SR et al. (1995). The McGill Quality of Life Questionnaire : a measure of quality of life appropriate for people with advanced disease : a preliminary study of validity and acceptability. Palliative Medicine, 9, 3 : 207–219.
- A19 · akas · Collins, R et al. (2016). Interpretation of the evidence for the efficacy and safety of statin therapy. The Lancet, 388, 10059 : 2532–2561.
- A20 · lgxy · Communiqué de presse, Casteel B (2016). Evacetrapib Fails to Reduce Major Adverse Cardiovascular Events. Press release, American College of Cardiology, 3d April.
- A21 · 4pqp · Coogan, PF et al. (2002). Statin Use and the Risk of Breast and Prostate Cancer. Epidemiology, 13, 3 : 262–267.
- A22 · gm8p · De Ferranti, S ; Ludwig, DS (2008). Storm over Statins — The Controversy Surrounding Pharmacologic Treatment of Children. N Engl J Med, 359 : 1309–1312.
- A23 · ptkm · de Lorgeril, M (2009). Disappointing recent cholesterol-lowering drug trials : is it not time for a full reappraisal of the cholesterol theory ? World Rev Nutr Diet., 100 : 80–89.
- A24 · api1 · de Lorgeril, M (2012). The JUPITER and statin controversy. Conférence invitée (diaporama), American Heart Association, Los Angeles, November 4.
- A25 · y2hv · de Lorgeril, M (2015). Score calcique, infarctus et statines. Article du blog michel.delorgeril.info
- A26 · 2gkg · de Lorgeril, M (2016). Où sont passés les 10 000 décès dus aux arrêts de statines ? Article du blog michel.delorgeril.info
- A27 · gmr3 · de Lorgeril, M ; Rabaeus, M (2015). Beyond Confusion and Controversy, Can We Evaluate the Real Efficacy and Safety of Cholesterol-Lowering with Statins ? Journal of Controversies in Biomedical Research, 1, 1 : 67–92.
- A28 · ocbj · Detrano, R et al. (2008). Coronary Calcium as a Predictor of Coronary Events in Four Racial or Ethnic Groups. N Engl J Med, 358 : 1336–1345.
- A29 · ax9f · Devroey, D (2003). ASCOT-LLA : questions about the benefits of atorvastatin. The Lancet 361, 9373 : 1986.
- A30 · eskn · Diamond, DM ; Ravnskov, U (2015) How statistical deception created the appearance that statins are safe and effective in primary and secondary prevention of cardiovascular disease. Expert Review of Clinical Pharmacology, 8, 2 : 201–210. (Texte intégral : https://www.drperlmutter.com/wp-content/uploads/2015/02/Statin-data-corruption.pdf)
- A31 · 85v6 · Dujardin, JJ ; Cambou, JP (2005). Épidémiologie de l’infarctus du myocarde. EMC – Cardiologie-Angéiologie, 2, 4 : 375–387.
- A32 · 3ekw · Dupagne, D (2013). La saga du cholestérol. Blog Atoute.org.
- A33 · 7bj9 · Dupagne, D (2016). Le grand bluff du cholestérol. Blog Atoute.org.
- A34 · 30vx · Duval, S (2015). Des conflits d’intérêts cachés devant un million de téléspectateurs. Site du Formindep.
- A35 · 2ivb · Engdhal, W (2015). Shocking Report from Medical Insiders. Site New Western Look.
- A36 · o3k9 · Fellström, BC et al. (2009). Rosuvastatin and Cardiovascular Events in Patients Undergoing Hemodialysis. N Engl J Med, 360 : 1395–1407.
- A37 · 3q6d · Fruchart, JC ; Duriez, P (2017). Statines – Encyclopedia Universalis.
- A38 · l8zj · Gigerenzer, G et al. (2010). Misleading communication of risk. BMJ 341:c4830.
- A39 · 0g7l · Girard, M (2011). Médicaments dangereux chez les personnes âgées. Site Web du Dr Marc Girard.
- A40 · 20qi · Girard, M (2013). Le débat sur la transparence des essais cliniques. Site Web du Dr Marc Girard.
- A41 · b8s7 · Girard, M (2016). MEDIATOR : à qui profite le scandale ? Site Web du Dr Marc Girard.
- A42 · yf63 · Girard, M (2019). Livre(s) sur les vaccins : les pièges de la fausse expertise… Site Web du Dr Marc Girard.
- A43 · yh1o · Goldstein, MR et al. (2008). Cholesterol, statins, and mortality. Correspondence in The Lancet, 371, 9619 : 1161 ; author reply : 1162–3.
- A44 · pnfb · Golomb, BA ; Evans, MA (2008). Statin adverse effects : a review of the literature and evidence for a mitochondrial mechanism. Am J Cardiovasc Drugs, 8 : 373–418.
- A45 · f1pd · Gouvernement du Canada (27 mars 2024). Ezetrol (ézétimibe) et les risques de lésions hépatiques d’origine médicamenteuse et de réactions indésirables cutanées graves. Communication des risques pour les professionnels de la santé.
- A46 · 42sx · Graveline, D (2015). Adverse Effects of Statin Drugs : a Physician Patient’s Perspective. Journal of American Physicians and Surgeons, 20, 1 : 7–11.
- A47 · 385p · Gæde, P et al. (2003). Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med, 348 : 383–393.
- A48 · 5h50 · Hayward, RA ; Krumholz, HM (2012). Three Reasons to Abandon Low-Density Lipoprotein Targets. An Open Letter to the Adult Treatment Panel IV of the National Institutes of Health. Cardiovascular Quality and Outcomes, 5 : 2–5.
- A49 · lxjs · Hayward, RA et al. (2006). Narrative Review : Lack of Evidence for Recommended Low-Density Lipoprotein Treatment Targets : A Solvable Problem. Annals of Internal Medecine, 145, 7 : 520–530.
- A50 · zl98 · Horton, R (2015). Off-line : What is medicine’s 5 sigma ? The Lancet, 385 : 1380.
- A51 · mkhq · Huang, X et al. (2015). Statins, plasma cholesterol, and risk of Parkinson’s disease : A prospective study. Movement Disorders, January, 30, 4 : 552–559.
- A52 · aiyk · Hung, SH et al. (2014). Statin use and thyroid cancer : a population-based case-control study. Clin Endocrinol (Oxf), 83, 1 : 111–116.
- A53 · wawu · Huston, L (2016). Novartis Contest Rewards Positive Peer Review Articles About Entresto. Site Cardio Brief.
- A54 · nm7g · Kendrick, M (2022). Pfizer and me – Best Buddies. Blog de Malcolm Kendrick, 21 mars.
- A55 · me3a · Khan, SF et al. (2022). PCSK9 inhibitors and ezetimibe with or without statin therapy for cardiovascular risk reduction : a systematic review and network meta-analysis. BMJ 377 : e069116.
- A56 · xamh · Kjekshus, J et al. (2007). Rosuvastatin in Older Patients with Systolic Heart Failure. N Engl J Med, 357 : 2248–2261.
- A57 · pekk · Klop, C et al. (2013). About “Statin Use and Reduced Cancer-Related Mortality”, letter to the Editor. N Engl J Med, 368 :574–577. doi:10.1056/NEJMc1214827
- A58 · sbbw · Knopp, RH et al. (2006). Efficacy and safety of atorvastatin in the prevention of cardiovascular end points in subjects with type 2 diabetes : the Atorvastatin Study for Prevention of Coronary Heart Disease Endpoints in non-insulin-dependent diabetes mellitus (ASPEN). Diabetes Care, 29, 7 : 1478–85.
- A59 · rm0y · Kristensen, ML et al. (2015). The effect of statins on average survival in randomised trials, an analysis of end point postponement. BMJ Open 5n 9:e007118. doi:10.1136/bmjopen-2014–007118
- A60 · 7fzk · Kutner, JS et al. (2015). Safety and Benefit of Discontinuing Statin Therapy in the Setting of Advanced, Life-Limiting Illness. A Randomized Clinical Trial. JAMA Intern Med., 175, 5 : 691–700.
- A61 · 4z0a · Le Borgne, C (2015). Conflits d’intérêts : Pr Even, l’arroseur arrosé. Site Egora.fr.
- A62 · o8f0 · Lefèvre, S (2016). Les cinq méthodes de l’industrie pharmaceutique pour nous bourrer de médicaments inutiles. Site Reporterre.
- A63 · y24d · Lehmann, C ; Winckler, M (2003). Cholestérol : une information biaisée, une démarche incohérente. (Non publié)
- A64 · 3dsq · Lei, Q et al. (2014). Statins in nervous system-associated diseases : angels or devils ? Pharmazie, 69, 6 : 448–454.
- A65 · bv17 · Leuschen, J et al. (2013). Association of Statin Use With Cataracts : A Propensity Score–Matched Analysis. JAMA Ophtalmol., 131, 11 : 1427–1434.
- A66 · dnx7 · Leutner, M, et al. (2019). Diagnosis of osteoporosis in statin-treated patients is dose-dependent. Annals of the Rheumatic Diseases, 78 : 1706–1711. doi:10.1136/annrheumdis-2019–215714
- A67 · 8mxt · Malhotra, A et al. (2016). Opinion : More clarity needed on the true benefits and risks of statins. Prescriber, November.
- A68 · xb71 · Mann, GV et al. (1972). Atherosclerosis in the Masai. American Journal of Epidemiology 95, 1 : 26–37.
- A69 · ayz3 · Mansi, I et al. (2015). Statins and new-onset diabetes mellitus and diabetic complications : a retropspective cohort study of US healthy adults. Journal of General Internal Medicine, 30, 11 : 1599–1610.
- A70 · 3d2a · McDermott, N (2016). Millions are ‘needlessly’ taking statins to ward off heart attack, due to ‘FLAWED’ evidence of benefits. The Sun, 25 November.
- A71 · glj5 · McDougall, JA et al. (2013). Long-Term Statin Use and Risk of Ductal and Lobular Breast Cancer among Women 55 to 74 Years of Age. Cancer Epidemiology, Biomarkers & Prevention, 22, 9 : 1529–1537.
- A72 · rlre · Miller, DW (2015). Fallacies in Modern Medicine : Statins and the Cholesterol-Heart Hypothesis. Journal of American Physicians and Surgeons, 20, 2 : 54–56.
- A73 · vavm · Muldoon, MF et al. (1990). Lowering cholesterol concentrations and mortality : a quantitative review of primary prevention trials. BMJ, 301 : 309–314.
- A74 · zugb · Möhlenkamp S et al. (2008). Running : the risk of coronary events †: Prevalence and prognostic relevance of coronary atherosclerosis in marathon runners. Eur Heart J, 29, 15 : 1903–1910.
- A75 · bi09 · Nielsen SF et al. (2012). Statin Use and Reduced Cancer-Related Mortality. N Engl J Med, 367 : 1792–1802. doi:10.1056/NEJMoa1201735
- A76 · rlx6 · Nissen, SE et al. (2024). A Technology-Assisted Web Application for Consumer Access to a Nonprescription Statin Medication. Journal of the American College of Cardiology, ISSN 0735–1097 : In press.
- A77 · 4j5b · No author (1993). Design and baseline results of the Scandinavian Simvastatin Survival Study of patients with stable angina and/or previous myocardial infarction. Am J Cardiol., 71, 5 : 393–400.
- A78 · u96l · No authors (1996). West of Scotland Coronary Prevention Study : identification of high-risk groups and comparison with other cardiovascular intervention trials. Lancet, Nov 16, 348, 9038:1339–42.
- A79 · d41t · Non signé (2004). Marc Girard, un expert judiciaire en terrain miné. Le Moniteur des pharmacies, 2562, cahier 1.
- A80 · pofy · Nordström, T et al. (2015). The risk of prostate cancer for men on aspirin, statin or antidiabetic medications. European Journal of Cancer, 51, 6 : 725–733.
- A81 · 41og · O’Riordan, M (2014). WOSCOPS at 20 Years : Study Shows Lifetime Benefit With 5 Years of Statin Therapy. Medscape Medical News from the American Heart Association (AHA) 2014 Scientific Sessions.
- A82 · lmoy · Okuyama H et al. (2015). Statins stimulate atherosclerosis and heart failure : pharmacological mechanisms. Expert Review of Clinical Pharmacology, 8, 2.
- A83 · o8hq · Otsuki T et al. (2007). Relationship Between Arterial Stiffness and Athletic Training Programs in Young Adult Men. Am J Hypertens, 20, 9 : 967–973.
- A84 · qk3n · Palmer, C et al. (2012). Benefits and Harms of Statin Therapy for Persons With Chronic Kidney Disease : A Systematic Review and Meta-analysis. Ann Intern Med., 157, 4 : 263–275.
- A85 · y4nb · Pedersen, TR et al. (1994). Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease : the Scandinavian Simvastatin Survival Study (4S). The Lancet, 344, 8934 : 1383–1389.
- A86 · 3zig · Pesty, F (2011). Statine en prévention ? Réalités ou marketing ? Blog Voix médicales. (Lien cassé)
- A87 · eah7 · Prinz, F et al. (2011). Believe it or not : how much can we rely on published data on potential drug targets ? Nature Reviews Drug Discovery, 10, 712.
- A88 · m3p5 · Prospective Studies Collaborators (2007). Blood cholesterol and vascular mortality by age, sex, and blood pressure : a meta-analysis of individual data from 61 prospective studies with 55 000 vascular deaths. The Lancet, 370, 9602 : 1829–1839.
- A89 · y54d · Prospective Studies Collaborators (2010). Efficacy and safety of more intensive lowering of LDL cholesterol : a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet, 376, 9753 : 1670–1681.
- A90 · w2le · Puri, R et al. (2015). Impact of statins on serial coronary calcification during atheroma progression and regression. J Am Coll Cardiol., 65, 13 : 1273–1282.
- A91 · z8ku · Ravnskov, U et al. (2016). Lack of an association or an inverse association between low-density-lipoprotein cholesterol and mortality in the elderly : a systematic review. BMJ Open, 6, 6 : e010401.
- A92 · jo92 · Ravnskov, U et al. (2018). LDL‑C does not cause cardiovascular disease : a comprehensive review of the current literature. Expert Review of Clinical Pharmacology, 11, 10 : 959–970.
- A93 · sbw5 · Ravnskov U et al. (2018). Ravnskov, U et al.. Inborn coagulation factors are more important cardiovascular risk factors than high LDL-cholesterol in familial hypercholesterolemia. Medical Hypotheses, 121 : 60–63.
- A94 · gmfp · Ridker, PM (2009). The JUPITER trial : results, controversies, and implications for prevention. Cardiovascular Quality and Outcomes, 2 : 279–285.
- A95 · x9y7 · Ridker, PM et al. (2008). Rosuvastatin to Prevent Vascular Events in Men and Women with Elevated C‑Reactive Protein. N Engl J Med 2008 ; 359 : 2195–2207.
- A96 · g2dp · Robinson, JG et al. (2015). Efficacy and Safety of Alirocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med, 372 : 1489–1499.
- A97 · fmn7 · Rohilla A, et al. (2016). Pleiotropic effects of statins : A boulevard to cardioprotection. Arabian Journal of Chemistry, 9, Supplement 1, September : S21–S27.
- A98 · u1j5 · Sabatine, MS et al. (2015). Efficacy and Safety of Evolocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med, 372 : 1500–1509.
- A99 · qzj1 · Santi, P et Motet L (2018). Anticor dépose plainte contre des médecins experts du cholestérol. Le Monde, 21 octobre.
- A100 · 4l0w · Schneider, L (2016). Zombie scientists. Blog For Better Science.
- A101 · bkbh · Sever, PS et al. (2003). Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial – Lipid Lowering Arm (ASCOT-LLA). Lancet 361, 9364 : 1149–1158.
- A102 · t8b9 · Sharp Collaborative Group (2010). Study of Heart and Renal Protection (SHARP): randomized trial to assess the effects of lowering low-density lipoprotein cholesterol among 9,438 patients with chronic kidney disease. Am Heart J., 160, 5 : 785–794.
- A103 · opln · Shaw, LJ et al. (2015). The Never-Ending Story on Coronary Calcium : Is it Predictive, Punitive, or Protective ? Journal of the American College of Cardiology, 65, 13 : 1283–1285.
- A104 · vip2 · Stambach, F (2014). L’effet diabétogène des statines : Premières notifications et revue de la littérature. Thèse de médecine, le 20 mai. Université de Limoges (France).
- A105 · fuhq · Strippoli, GFM ; Craig, JC (2009). Sunset for Statins after AURORA ? N Engl J Med, 360 : 1455–1457.
- A106 · s9uf · Stroes, ES et al. (2015). Statin-associated muscle symptoms : impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J., 36, 17 : 1012–22.
- A107 · cm84 · Tavazzi, L et al. (2008). Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet, 372, 9645 : 1231–1239.
- A108 · f6r7 · Taylor, AJ et al. (2012). Paradoxical progression of atherosclerosis related to low-density lipoprotein reduction and exposure to ezetimibe. European Heart Journal 33, 23 : 2939–2945.
- A109 · 2ifm · Thompson, R et al. (2014). Concerns about the latest NICE draft guidance on statins. Lettre au président du National Institute for Health and Care Excellence et au Secrétaire d’État à la Santé (Secretary of State for Health), Londres, 10 juin.
- A110 · il9k · Valenti, V et al. (2015). A 15-Year Warranty Period for Asymptomatic Individuals Without Coronary Artery Calcium : A Prospective Follow-Up of 9,715 Individuals. JACC : Cardiovascular Imaging, 8, 8 : 900–909.
- A111 · gt4z · Vercoustre, L (2019). Homéopathie, médecine et anti-médecine. Blog personnel, 4 juillet.
- A112 · xw6c · Zhan, S et al. (2018). Ezetimibe for the prevention of cardiovascular disease and all-cause mortality events. Cochrane Database Syst Rev 11, 11 : CD012502.
- A113 · dyig · Zhou, F et al. (2018). High Low-Density Lipoprotein Cholesterol Inversely Relates to Dementia in Community-Dwelling Older Adults : The Shanghai Aging Study. Frontiers in Neurology, 12 November. doi:10.3389/fneur.2018.00952
⇪ ✓ Ouvrages et rapports
- B1 · g7s3 · Afssaps (2005). Prise en charge thérapeutique du patient dyslipidémique — Argumentaire. Document PDF.
- B2 · eht7 · Angell, M (2005). La vérité sur les compagnies pharmaceutiques : Comment elles nous trompent et comment les contrecarrer. Le Mieux-être. Trad. P. Even.
- B3 · oi79 · Clapin, A (2018). Enquêtes médicales & évaluation des médicaments : de l’erreur involontaire à l’art de la fraude. Éditions Désiris. ➡ Existe aussi en version Kindle sur Amazon.
- B4 · ad6o · de Lorgeril, M (2011). Prévenir l’infarctus et l’accident vasculaire cérébral. Thierry Souccar.
- B5 · 8wtg · de Lorgeril, M (2013). Cholestérol, mensonges et propagande. Thierry Souccar, 2e édition. ➡ Éviter la version Kindle qui est mal codée.
- B6 · 588e · de Lorgeril, M (2015). L’horrible vérité sur les médicaments anti cholestérol – Comment les statines empoisonnent en silence. Thierry Souccar.
- B7 · l4hy · Even P (2015). Corruptions et crédulité en médecine : Stop aux statines et autres dangers. Le Cherche Midi.
- B8 · egyj · FDA Drug Safety Communication (2011). New restrictions, contraindications, and dose limitations for Zocor (simvastatin) to reduce the risk of muscle injury. U.S. Food & Drug Administration.
- B9 · nw1n · Gøtzsche, P (2013). Deadly Medicines and Organised Crime : How Big Pharma Has Corrupted Healthcare. Radcliffe.
- B10 · 0cli · Pignarre, P (2004). Le grand secret de l’industrie pharmaceutique. La Découverte/Poche.
- B11 · s0fb · Seguy, B (2006). Prévenir le risque juridique en obstétrique. Masson.
- B12 · rxuy · Union Européenne (2014). Clinical trials – Regulation EU No 536/2014.
⇪ ✓ Publications diverses
- C1 · wueo · ANSM (2011). PRAVASTATINE ZENTIVA 20 mg – Notice.
- C2 · 3jl7 · American Heart Association (2013). Doctor discussion is key for cholesterol treatment.
- C3 · vlz1 · Cerner Multum, Inc (2017). Pravastatin Side Effects.
- C4 · 3s44 · ClinicalTrials.gov. A service of the U.S. National Institutes of Health.
- C5 · ebn1 · Malhotra, A (2024). Film “First Do No Pharm”.
- C6 · vt9l · Martin, N (2017). Cholestérol : maladie ou scandale ? Émission La Méthode scientifique, France Culture, 18/12/2017. Intervenants : Michel de Lorgeril, Gérard Helft, Anne Georget et Sylvain Duval.
- C7 · qg8m · Patrick (2023). Risque alimentaire : la notion de taille d’effet pour le quantifier. Site Nutriting.
- C8 · yv7l · Reuters (2016). Merck says U.S. FDA reject its claim that Zetia and Vytorin cut heart risk. Communiqué de presse.
- C9 · 5wge · Transparence-Santé. Base de données publique des liens d’intérêts avec les acteurs du secteur de la santé (France).
- C10 · yupz · University of California San Diego. Statin Effects Study.
- C11 · kcro · Wikipedia (2017). Philippe Even et l’industrie pharmaceutique : positions et liens financiers.
⇪ ▷ Liens
- N1 · 23mb · Statine – Wikipedia
- N2 · 59jy · Maladie cardio-vasculaire – Wikipedia
- N3 · jrzg · Accident vasculaire cérébral – AVC – Wikipedia
- N4 · 600f · Cholestérol – Wikipedia
- N5 · sx74 · Cholestérol : votre feuille d’analyse à la loupe
- N6 · xrt5 · Occlusion totale chronique d’une artère coronaire – Wikipedia
- N7 · ty6z · Angiographie – Wikipedia
- N8 · eb7u · Stent – Wikipedia
- N9 · 9smu · Atorvastatine – Wikipedia
- N10 · a5km · Pravastatine – Wikipedia
- N11 · ax0h · Rosuvastatine – Wikipedia
- N12 · hhxr · Base de données bibliographiques en périnatalité
- N13 · ukh3 · Diagnostic prénatal non invasif : avancées historiques, obstacles et espoirs
- N14 · dec9 · Open House for Butterflies : Ruth Krauss’s Final and Loveliest Collaboration with Maurice Sendak
- N15 · tvc0 · Élaboration de recommandations de bonne pratique : Méthode “Recommandations pour la pratique clinique”
- N16 · pdu3 · Conflit d’intérêts – Wikipedia
- N17 · km36 · Balance bénéfice-risque – Wikipedia
- N18 · ww0h · Code de déontologie médicale (France) – Wikipedia
- N19 · 422x · Code de la santé publique – article L‑1111–4
- N20 · 8scb · La notion de contrat de soins
- N21 · 5jbl · Arrêt Mercier – 20 mai 1936
- N22 · gk9x · Cherry picking – Wikipedia
- N23 · t3s5 · Pfizer Throws In the Lipitor Marketing Towel
- N24 · oqv3 · Kendrick, M (2024). The legal case – naming a few names. Personal website.
- N25 · 7cuu · Michel de Lorgeril – Wikipedia
- N26 · c7vm · Biais de publication – Wikipedia
- N27 · 87qm · Lupus – Wikipedia
- N28 · 19y8 · Top line results of Lupuzor™ Pivotal Phase III Trial
- N29 · 0zr0 · Un nouvel espoir contre le lupus
- N30 · bwxr · Want to Know If Someone Is Manipulating Data ?
- N31 · cy0h · Marcia Angell dénonce la manipulation de la recherche clinique et le contrôle de l’information médicale par l’industrie pharmaceutique
- N32 · 3xw9 · Déclaration choquante d’un initié du domaine médical
- N33 · syjl · Médecine translationnelle – Wikipedia
- N34 · cnw5 · An Apple for the Teacher(s)
- N35 · i5f1 · Michel de Lorgeril – Psiram
- N36 · sulv · Lipoprotéine de basse densité – LDL – Wikipedia
- N37 · 2ss4 · Lipoprotéine de haute densité – HDL – Wikipedia
- N38 · axd7 · Étude randomisée en double aveugle – Wikipedia
- N39 · p27t · Clinical endpoint – Wikipedia
- N40 · ei2t · Bilan lipidique – Analyses médicales – Doctissimo
- N41 · tw5h · Antioxydant – Wikipedia
- N42 · s6oz · Acide gras insaturé – Wikipedia
- N43 · mnd6 · Athérome ou athérosclérose – Wikipedia
- N44 · 5m77 · Infarctus du myocarde – Wikipedia
- N45 · pgyc · Endothélium – Wikipedia
- N46 · 2lfu · Hypercholestérolémie – Wikipedia
- N47 · xfrt · cérivastatine – Wikipedia
- N48 · xrjt · Scandale Vioxx : Merck a laissé mourir des dizaines de milliers de personnes
- N49 · vu9f · Essai clinique saison 5 : l’hypothèse primaire
- N50 · 3fsc · Recherche clinique des CHU : les résultats de la moitié des essais ne sont jamais communiqués ! Gaspillage d’argent public ??
- N51 · xjv8 · Résultats comparés des essais cliniques sur les statines avant et après 2004 (mise en place de la nouvelle règlementation) (lien cassé)
- N52 · mlow · Clinical Trial Service Unit – CTSU
- N53 · c8lf · https://fr.wikipedia.org/wiki/Anacetrapib
- N54 · ck62 · JUPITER trial – Wikipedia
- N55 · 1et4 · La commission d’enquête Sorbonne Université – CNRS concernant la mise en cause de publications de Catherine Jessus conclut à l’absence de méconduite scientifique
- N56 · q11n · Pravda of Jessus report, CNRS Politburo scared of own people
- N57 · a3u9 · Diabète de type 2 – Wikipedia
- N58 · 9fke · Méta-analyse – Wikipedia
- N59 · 7u7h · Randomisation – Wikipedia
- N60 · 5r9w · Simvastatine – Wikipedia
- N61 · cthb · Ézétimibe – Wikipedia
- N62 · t3m6 · Ezetimibe/simvastatin – Wikipedia
- N63 · dp5y · How statistical deception created the appearance that statins are safe and effective in primary and secondary prevention of cardiovascular disease
- N64 · dey8 · Number needed to treat – Wikipedia
- N65 · h2nb · Pharmacovigilance – Wikipedia
- N66 · v738 · Créatine kinase – Wikipedia
- N67 · 1f49 · Rhabdomyolyse – Wikipedia
- N68 · kow3 · Video “Dr Aseem Malhotra” – The Joe Rogan Experience
- N69 · gn1m · Boston Heart Diagnostics Introduces StatinSmart™
- N70 · cfir · Épidémiologie – Wikipedia
- N71 · 6lok · Myalgie – Wikipedia
- N72 · u1zr · Tendinite – Wikipedia
- N73 · 9wow · Voie du mévalonate – Wikipedia
- N74 · u5h3 · Ubiquinone – Wikipedia
- N75 · 2fso · Sarcopénie – Wikipedia
- N76 · isyw · Fibrillation atriale – Wikipedia
- N77 · alc0 · Mitochondrie – Wikipedia
- N78 · g2gs · Organite – Wikipedia
- N79 · 7gdc · Cytoplasme – Wikipedia
- N80 · ghg8 · Cataracte – Wikipedia
- N81 · fij6 · Dégénérescence maculaire liée à l’âge (DMLA) – Wikipedia
- N82 · j7u1 · Neuropathie – Wikipedia
- N83 · qo0u · Helping Kids Eat Healthy
- N84 · wtej · Agence nationale de sécurité du médicament et des produits de santé – ANSM
- N85 · dlmy · Résistance à l’insuline – Wikipedia
- N86 · rad8 · Hypogonadisme – Wikipedia
- N87 · awy2 · Testostérone – Wikipedia
- N89 · uy2s · Coenzyme Q10 – Wikipedia
- N90 · qu9h · Hème a – Wikipedia
- N91 · 6qeo · Adénosine triphosphate (ATP) – Wikipedia
- N92 · 1p65 · Ménaquinone (vitamine K2) – Wikipedia
- N93 · yn4u · Gla domain – Wikipedia
- N94 · ohhu · Glutathion peroxydase – Wikipedia
- N95 · 5gjv · Stress oxydant – Wikipedia
- N96 · 9vht · Sélénoprotéine – Wikipedia
- N97 · g5ct · Cardiomyopathie – Wikipedia
- N98 · u47r · Pleiotropy (drugs) – Wikipedia
- N99 · jxk2 · NF-κB – Wikipedia
- N100 · 4kqg · Affaire du Mediator – Wikipedia
- N101 · j0jl · En prévention primaire, les statines réduisent la mortalité coronarienne de 28 % chez les hommes ayant un taux élevé de LDL-cholestérol
- N102 · b76u · Infarctus du myocarde – présentation
- N103 · nhfa · Score calcique
- N104 · gz6h · Tomodensitométrie – Wikipedia
- N105 · yseg · Coronary Artery Calcium Score for Long-term Risk Classification in Individuals With Type 2 Diabetes and Metabolic Syndrome From the Multi-Ethnic Study of Atherosclerosis
- N106 · kpej · Syndrome métabolique – Wikipedia
- N107 · i55q · The Arrow #56 – Michael Eades
- N108 · u1z4 · Calcium Density of Coronary Artery Plaque and Risk of Incident Cardiovascular Events
- N109 · hh6x · Anti-PCSK9 – Wikipedia
- N110 · 7b0e · Post hoc analysis – Wikipedia
- N111 · hkbp · NPC1 – Wikipedia
- N112 · 4flm · Darapladib – Wikipedia
- N113 · r00x · Lipoprotein-associated phospholipase A2 – Wikipedia
- N114 · ze3o · Evacetrapib – Wikipedia
- N115 · qanw · Hypercholestérolémie familiale – Wikipedia
Article créé le 15/03/2017 - modifié le 14/07/2025 à 15h10






 9010
9010


1 thoughts on “Statines et médicaments anticholestérol”