
Cette maladie neurodégénérativeN1 affecte le tissu cérébral en détruisant des neurones, ce qui se traduit par la perte progressive et irréversible des fonctions mentales, et notamment de la mémoire. C’est la forme la plus répandue de déclin cognitif dans les sociétés industrialisées.
Loin de prétendre couvrir exhaustivement le sujet de la maladie d’AlzheimerN2, je souhaite évoquer quelques travaux qui ouvrent des pistes nouvelles.
Sommaire
⇪ Le protocole MEND
Ces travaux sont menés par l’équipe du Dr Dale Bredesen, fondateur en 1998 du Buck Institute for Research on Aging (USA).
L’article Reversal of cognitive decline in Alzheimer’s disease (Dave et al., 2016N3) présentait les premiers résultats de cette nouvelle approche qu’il convient de mettre en contexte. Il s’agissait d’une expérimentation du protocole MEND (Metabolic Enhancement for NeuroDegeneration) sur 10 personnes souffrant de déclin cognitif — pas spécifiquement Alzheimer — traité sur une durée de 5 à 24 mois. Des progrès significatifs ont été mesurés chez 8 de ces patients.
➡ Ce qui fait dire à des charlatans New-Age qu’un mystérieux « protocole M » découvert par une équipe de chercheurs californiens guérirait 8 patients Alzheimer sur 10… Comme convenu, ce traitement aurait été « enterré par les Autorités et caché au grand public » car il dessert les intérêts de Big Pharma ! Voir mon article “Health coaching”: business models en roue libre…
La page New Hope that Alzheimer’s Can Be Prevented — and Even Cured (2017N4) contient le résumé d’un entretien entre Chris Kresser et Dale Bredesen. Dès le départ, ces travaux sont situés dans un cadre de médecine fonctionnelleN5 :
L’approche conventionnelle est souvent en retard — la surprise est que l’amyloïde très associé à la maladie d’Alzheimer est une réponse protectrice aux agressions de microbes ou de toxines. Par conséquent, toute tentative d’élimination de l’amyloïde devrait être précédée de la suppression de l’agression qui induit cette réponse.
Après avoir présenté l’équilibre entre divers peptides des synapses reliant les neurones, dont certains sont constructeurs (synaptoblastes) et les autres destructeurs (synaptocastes) — un mécanisme similaire à celui dont le déséquilibre entraîne l’ostéoporose — Bredesen propose une liste des cinq types d’Alzheimer décrits dans son ouvrage The End of Alzheimer’s (2017N6) :
- Type 1, inflammatoire (« chaud ») : l’inflammation peut être due à des agents pathogènes ou à d’autres facteurs inflammatoires tels que les graisses trans.
- Type 2, atrophique (« froid ») associé à des réductions du support trophique telles que le facteur de croissance nerveuse, le facteur neurotrophique dérivé du cerveau, l’estradiol, la vitamine D et d’autres supports trophiques, hormonaux ou nutritionnels. Il existe aussi une combinaison commune de type 1 et type 2 — type 1.5 glycotoxique (« doux ») — qui combine l’inflammation du glucose élevé (par exemple via AGEN7) avec la perte trophique de la résistance à l’insulineN8.
- Type 3, toxique (« méchant ») associé à une exposition à des toxines telles que des mycotoxinesN9 (par exemple, des trichothécènes ou de l’ochratoxine A) ou des chimioxines (par exemple le mercure).
- Type 4, vasculaire (« pâle ») associé à un soutien vasculaire réduit.
- Type 5, traumatique (« étourdi ») associé à un traumatisme crânien antérieur.
Les causes ayant été identifiées, et soigneusement quantifiées pour chaque patient, un traitement individualisé est envisageable. Au total, 150 facteurs liés aux habitudes de vie ont été signalés, qui expliqueraient la survenue de 95 % des cas d’Alzheimer, les 5 % restants étant attribués à des facteurs génétiques.
Les essais cliniques ont montré que les symptômes pouvaient régresser significativement pourvu que la maladie ne soit pas à un stade trop avancé. C’est l’objectif du protocole ReCODE.
Bredesen expliqueN4 :
La clé est que l’ensemble du programme fonctionne de concert, donc il existe un effet de seuil, tout comme on l’observe dans le traitement des maladies cardiovasculaires. Il semble y avoir des effets bénéfiques majeurs induits par l’inversion de la résistance à l’insuline, l’optimisation du sommeil, l’exercice régulier, l’élimination des expositions toxiques […], l’optimisation du soutien hormonal […], l’optimisation de la nutrition (par exemple, se prémunir contre un taux élevé d’homocystéine [N10], un taux faible de vitamines D et B12, de magnésium etc.), la lutte contre des agents pathogènes (par exemple la borréliose [N11]), une réduction de l’inflammation — mais surtout, des causes de l’inflammation —, une optimisation de l’entraînement du cerveau et la réduction du stress.
En réalité, seules des personnes souffrant de troubles cognitifs légers ont été incluses dans les études menées par l’équipe de Bredesen, donc aucune vraiment diagnostiquée Alzheimer. L’étude mise en exergue (Hathaway A et al., 2018N12), sans randomisation ni groupe témoin, a été publiée dans la revue prédatriceN13 Journal of Alzheimers Disease & Parkinsonism. Une étude critique des preuves à l’appui des thèses de Bredesen est apparue dans The Lancet (Hellmuth J, 2020N14). Des publications dont Dale Bredesen est co-auteur font l’objet de signalements sur PubPeer.
Jérémy Anso commente une autre étude clinique en cours, et plus généralement la démarche très lucrative de cette équipe en matière de prévention (2025N15) :
[…] les auteurs ont mis la barre très haute pour s’assurer d’avoir des participants avec un haut niveau d’engagement, de ressources personnelles avec un soutien social sérieux (il faut un partenaire d’étude impliqué au quotidien). Ces critères favorisent l’inclusion de personnes socio-économiquement favorisées, plus autonomes, éduquées et motivées pour prendre leur santé en main. Les laboratoires pharmaceutiques ne s’y prennent pas autrement pour maximiser les chances d’avoir des résultats positifs… qui disparaîtront dans la population générale. […]
Rien que le fait d’avoir la visite régulière d’un coach sportif, d’un coach santé, et d’un nutritionniste va permettre d’engager la personne dans des interactions sociales et sportives fortes largement en défaveur du groupe contrôle.
[…]
La communauté médicale est loin de se tourner les pouces. Mais elle évalue des programmes réalistes et accessibles à tous. Surtout, elle propose d’évaluer d’abord, pour actualiser les recommandations ensuite.Le Dr Bredesen et son équipe d’Apollo Health ont fait l’inverse. Ils ont trouvé le remède miracle avant d’obtenir des preuves tangibles et rigoureuses. Un remède qui ne bénéficie pas aujourd’hui d’étude clinique solide, publiée dans des revues de qualité.
Pire, le programme proposé par ReCODE semble destiné à une clientèle aisée qui pourra s’acheter 9 mois de menus « low carb » pour la modique somme de 7000 $. Le programme soumis à l’étude clinique est digne d’une clinique privée des stars de cinéma d’Hollywood.
⇪ Rôle du peptide amyloïde Aβ
Des travaux soulignent une ressemblance de la maladie d’Alzheimer avec les maladies à prions comme celle de Creutzfeldt-Jakob :
[…] les protéines impliquées dans la maladie d’Alzheimer changent de forme, ce qui modifie leur action à l’échelle cellulaire. Il faut savoir que le rôle d’une protéine dépend généralement de sa forme (qui elle-même dépend en grande partie de l’enchaînement des acides aminés qui la compose). C’est ce changement de morphologie qui confère au peptide Aβ [N16] des propriétés totalement différentes de celles de sa forme normale. Devenu capable de s’auto-agréger, il peut former les dépôts de fibres amyloïdes qui sont probablement à l’origine de la mort des neurones.
Mais ce n’est pas tout : les chercheurs ont démontré que les formes toxiques sont capables de forcer leurs alter-egos normaux à les imiter, et à adopter eux aussi une forme pathogène ! Ce phénomène, dit « auto-réplicatif », explique comment une cellule malade produisant la forme toxique du peptide peut « contaminer » la cellule voisine.
Cette contagion de proche en proche explique aussi pourquoi, durant l’évolution de la maladie d’Alzheimer, la propagation des lésions cérébrales s’étend progressivement à tout le cerveau en suivant un schéma bien déterminé, chez tous les patients.
Cette citation est issue d’un article d’Angélique Igel-Egalon sur le site The Conversation (2018N17) reproduit par de nombreux médias francophones. L’auteure et le chef de rubrique Santé ont aimablement listé les liens importants en réponse à un commentaire où j’avais signalé l’article de Aleksandr A Rubel et al. (2013N18). Je les rappelle en partie ci-dessous.
Melanie Meyer-Luehmann et al. (2006N19), Jan Stöhr et al. (2014N20) ont démontré l’induction expérimentale de plaques amyloïdes sur des souris.
En 2015, Zane Jaunmuktane et al.N21 ont constaté une transmission par contagion de la pathologie associée au peptide Aβ, notamment via les traitements par hormone de croissance qui avaient contribué à disséminer la maladie de Creutzfeldt-Jakob (Ritchie DL et al., 2017N22 ; Frontzek K et al., 2016N23 ; Cali I et al., 2018N24). Les deux derniers auteurs signalent aussi que des greffes de dure-mèreN25 pourraient avoir causé une transmission du prion humain. Une autre contamination plus rare a pu être causée par des instruments de neurochirurgie (Jaunmuktane Z et al., 2018N26).
Sachant que différentes souches de prions ont été identifiées (Morales R, 2017N27), Angélique Igel-Egalon suggère qu’on désigne la maladie d’Alzheimer comme une « maladie de type prion » plutôt qu’une « maladie à prions »N17.
Plus récemment, Deepak Kumar et al. (2016N28) auraient « réhabilité » le peptide amyloïde AβN16 qui selon eux joue plutôt un rôle « protecteur » dans un mécanisme dont le dérèglement provoque la maladie d’Alzheimer :
On pense que la protéine Aβ [N16] est responsable de la mort neuronale dans la maladie d’Alzheimer. Aβ forme des agrégats insolubles dans le cerveau des patients atteints de la maladie d’Alzheimer, caractéristiques de la maladie. Aβ et sa propension à l’agrégation sont largement considérés comme intrinsèquement anormaux. Cependant, dans de nouveaux travaux, Kumar et al. montrent que Aβ est un antibiotique naturel qui protège le cerveau contre les infections. Le plus surprenant est que les agrégats Aβ capturent et emprisonnent les bactéries pathogènes. Il n’est pas clair si Aβ combat une infection réelle ou faussement perçue dans la maladie d’Alzheimer. Cependant, dans tous les cas, ces découvertes identifient des voies inflammatoires comme nouvelles cibles potentielles pour le traitement de la maladie d’Alzheimer.
Cette façon de voir me paraît en accord avec celle, décrite plus haut, à l’origine du protocole MEND. Selon Gina Kolata (New York TimesN29), le scénario de l’infection, vu par les chercheurs Rudolph Tanzi et Robert Moir, pourrait se résumer ainsi :
Un virus, un champignon ou une bactérie pénètre dans le cerveau en passant à travers une membrane — la barrière hémato-encéphalique [N30] — qui fuit à mesure que les gens vieillissent. Le système de défense du cerveau se précipite pour arrêter l’envahisseur en fabriquant une cage collante à partir de protéines, appelée bêta-amyloïde. Le microbe, comme une mouche dans une toile d’araignée, devient piégé dans la cage et meurt. Ce qui reste est la cage — une plaque qui est la marque distinctive de la maladie d’Alzheimer.
Alors que les protéines AβN16 ont jusqu’ici été considérées comme un déchet dont les fragments (peptides) s’accumulent dans le cerveau avec l’âge, Robert Moir avait remarqué leur similitude avec celles du système immunitaire inné, ce qui confirmerait qu’elles puissent intervenir dans la défense du cerveau contre des agressions microbiennesN29. L’expérimentation animale renforce cette hypothèse. Rudolph TanziN31 étudie par ailleurs le rôle médiateur du microbiote intestinalN32 dans ce processus. Certains gènes comme ApoE2 peuvent le retarder en facilitant l’élimination des fragments d’Aβ après qu’ils aient joué leur rôle défenseurN29.
Malgré les failles de « l’hypothèse amyloïde », certains industriels du médicament persistent à vendre des traitements supposés « réduire la formation de plaques bêta-amyloïdes dans le cerveau », alors que cette réduction ne s’est pas montrée protectrice du déclin cognitif. Cette promotion s’appuie sur des pratiques commerciales poussant les organismes de régulation à fermer les yeux sur l’incohérence d’essais cliniques (2025N33).
Selon William A Eimer et al. (2018N34), des agents infectieux à l’origine du mécanisme destructif pourraient être les virus de l’herpès : HSV1N35, HHV6N36, HHV7N37. Des travaux sur un modèle animalN38 suggèrent aussi qu’un agent pathogène bucco-dentaire (Porphyromonas gingivalis), au rôle majeur dans le déclenchement de parodontites, pourrait déclencher une neuroinflammation dans le cerveauN39 conduisant à la maladie d’Alzheimer.
L’inflammation provoque la mort de cellules nerveuses. La partie de la barrière hémato-encéphaliqueN30 qui devient la plus poreuse avec l’âge est celle qui protège l’hippocampe, siège de l’apprentissage et de la mémoire où les plaques d’Alzheimer se forment.
En réponse à mon commentaire, Angélique Igel-Egalon observe que l’étude de Deepak Kumar et al. (2016N28) ne dit rien de l’influence sur leur potentiel infectieux des structures et formes des oligomèresN40 du peptide amyloïde AβN16. Comme signalé précédemment, le problème est moins une accumulation passive de protéines que leur changement de forme qui modifie leur action à l’échelle cellulaireN17.
Si le problème réside dans la détérioration de la barrière hémato-encéphaliqueN30, toute intervention empêchant ou ralentissant cette détérioration devrait être protectrice de la maladie d’Alzheimer. Or un facteur important de cette dégradation pourrait être le stress, selon un mécanisme partiellement connu (Welcome MO & NE Mastorakis, 2020N41). La dégradation permet autant le passage de substances nocives en provenance de l’environnement que celui de lipides (via les lipoprotéines). C’est l’hypothèse de l’invasion des lipides formulée par Jonathan D’Arcy Rudge (2022N42) :
Le modèle d’invasion lipidique explique comment l’afflux d’acides gras libres liés à l’albumine via une barrière hémato-encéphalique perturbée induit des changements bioénergétiques et un stress oxydatif, stimule la neuro-inflammation induite par la microglie et provoque une amnésie antérograde. Il explique également comment l’afflux de lipoprotéines externes, qui sont beaucoup plus grandes et plus riches en lipides, notamment en cholestérol, que celles normalement présentes dans le cerveau, provoque des anomalies endosomales-lysosomales et une surproduction du peptide amyloïde‑β (Aβ). Cela conduit à la formation de plaques amyloïdes et d’enchevêtrements neurofibrillaires, les caractéristiques les plus connues de la maladie d’Alzheimer.
Des assemblages d’extraits de plantes sont proposés et vendus comme « remèdes miracles » pour la prévention et le traitement de la maladie d’Alzheimer. Voir par exemple une combinaison de nootropesN43 : millepertuis officinal, N‑acetyl L‑Carnitine, phosphatidylsérine, huperzine A, gingko bilboa, L‑glutamine, brahmi et vinpocétine, commercialisée par Advanced Biohealth. La vidéo interminable qui sert de “sales pitch” à ce produit présente toutes les caractéristiques d’une arnaque, mais l’avenir confirmera ou infirmera la validité de telles propositions.
Il faut redoubler de prudence — et faire preuve de scepticisme — à la lecture de tout article scientifique annonçant une avancée spectaculaire dans la compréhension et/ou le traitement de maladies comme Alzheimer. Voir par exemple l’article de Sylvain Lesné (personnage disparu) et collègues (2006N44) dont la manipulation frauduleuse d’images a été mise en évidence par les analyses automatiques (Schneider L, 2022N45). La fraude scientifique permet de gagner gros — quitte à tout perdre — quand on s’occupe de maladies réputées incurables.
⇪ Dépistage et prévention
Des recherches sont en cours pour proposer un dépistage précoce d’Alzheimer qui permettrait de démarrer un traitement dans la « phase silencieuse » de la maladie — voir par exemple Elena Sender (2017N46) et N47.
Keenan A Walker et al. (2017N48) ont montré que la présence de 3 ou plus biomarqueurs d’inflammation systémique (sur 5 mesurés) dans le sang de sujets d’âge moyen 53 ans avait augmenté significativement, 24 ans plus tard, l’incidence de la maladie d’Alzheimer, en diminuant notamment le volume de l’hippocampeN49. Je crois donc important de surveiller les taux sanguins susceptibles de signaler une inflammation : CPK (créatine kinaseN50), vitesse de sédimentationN51 et protéine C‑réactive — voir mon article Protéine C-réactive : panique !
La prise de médicaments anticholinergiquesN52 serait associée à un risque accru de démence (de 6 à 49 %) comme le signale une étude menée sur 284 343 sujets âgés de 82.2 ± 6.8 ans (Coupland CAC, 2019N53). La carence en cholineN54 est fréquente et touche 9 Américains sur 10. Lucy Mailing explique (voir mon article Choline) qu’elle est :
[…] un précurseur de l’acétylcholine [N55], un neurotransmetteur qui joue un rôle dans la mémoire, les rythmes circadiens et le contrôle musculaire, ainsi que de la sphingomyéline [N56] qui se trouve dans la gaine graisseuse entourant les fibres nerveuses et améliore la conduction des impulsions électriques.
L’article Association of Egg Intake With Alzheimer’s Dementia Risk in Older Adults (Pan Y et al., 2024N57) confirme ces observations à partir du suivi de 1024 patients d’Alzheimer âgés en moyenne de 81 ans :
Ces résultats suggèrent que la consommation fréquente d’œufs est associée à un risque plus faible de démence d’Alzheimer et de maladie d’Alzheimer, et que l’association avec la démence d’Alzheimer est partiellement médiée par la choline alimentaire.
La choline alimentaire est ici exclusivement celle contenus dans les jaunes d’œufs. Cette étude est basée sur des questionnaires nutritionnels, donc de niveau de preuve modéré. Toutefois, les chercheurs ont pu observer la moindre progression de la pathologie chez les consommateurs d’œufs (1 à 2 par semaine) en effectuant des autopsies des participants décédés.
En termes de prévention, les recommandations publiées sur ce site (voir notamment mon article Vivre bien et longtemps) sont en accord avec le programme ReCODE mentionné ci-dessus — et pour moins cher !
L’augmentation du facteur neurotrophique issu du cerveau (brain-derived neurotrophic factor, BDNFN58) que l’on observe dans les pratiques du demi-jeûne fractionné (voir mon article Jeûne et restriction calorique) et de l’entraînement fractionné de haute intensité (voir mon article Entraînement fractionné de haute intensité) fait partie des stratégies de prévention efficaces justifiées par l’expérimentation animale. Pour un exposé détaillé, suivre les liens sur cette page du site Mental Health Daily (2016N59).
⇪ Autres pistes
L’étude de Esme Fuller-Thomson & ZhiDi Deng (2019N60) basée sur l’autopsie de personnes décédées à plus de 80 ans, suggère que l’intoxication au plomb contenu dans les carburants — jusqu’à l’interdiction de cet additif — aurait pu avoir une incidence notable sur une encéphalopathie proche d’Alzheimer. Les taux de démence ont en effet baissé de 15 % par décennie depuis les années 1980, une diminution d’autant plus imprévue que des facteurs de risque de la maladie, comme l’obésité et le diabète, sont en plein essor. D’autres travaux ont montré une incidence plus élevée de la démence chez les personnes vivant près de grands axes routiers.
Une étude de Yakeel Quiroz et collègues (2020N61) révèle qu’un biomarqueur de diagnostic précoce efficace des maladies de HuntingtonN62 et d’Alzheimer pourrait être le taux élevé de neurofilament à chaîne légère (NfLN63) circulant dans le liquide céphalo-rachidien et détectable dans le sang. Ce signalement pourrait être efficace jusqu’à 22 ans avant l’apparition des premiers symptômes.
L’équipe de Xia Li et collègues a publié les premiers résultats d’une procédure chirurgicale expérimentale qui, selon eux, vise à traiter la maladie d’Alzheimer en manipulant les systèmes d’élimination des déchets du cerveau (2024N64).
Des essais ont lieu sur l’amélioration des capacités cognitives de patients atteints de maladie d’Alzheimer à un stade précoce ou moyen grâce à la consommation de TCM (triglycérides à chaîne moyenne, N65), par exemple Miho Ota et al. (2019N66). D’autres essais, toujours sur de petits nombres de malades — donc à faible niveau de preuve — ont montré un effet bénéfique de la consommation d’huile de noix de coco riche en acide laurique qui est un TCM à l’état naturel.
Il ne s’agit pas de « remèdes de grand mères » mais d’une recherche basée sur le constat que la maladie d’Alzheimer pourrait être désignée comme un « diabète de type 3 » comme proposé par Zuzanne M de la Monte et Jack R Wands (2008N67) : le cerveau produit sa propre insuline, et celui de patients Alzheimer ne souffrant pas de diabète de type 1 ou de type 2 présente une déficience en insuline, pourtant caractéristique du diabète. Par conséquent, tout traitement (préventif ou curatif) visant à favoriser la production de corps cétoniquesN68 pourrait être bénéfique aux patients Alzheimer.
Cette approche — appliquée aussi à la maladie de ParkinsonN69 et autres maladies neurodégénérativesN1 comme la sclérose latérale amyotrophique (Maladie de Charcot, N70) — incluerait un traitement métabolique similaire à celui du cancer (voir mon article Cancer - approche métabolique) et la pratique de diète cétogène (voir mon article). Avec pour seule réserve que, chez une personne âgée, un changement radical de régime alimentaire peut se traduire par la perte d’appétit et par conséquent une dénutrition annihilant le bénéfice escompté (Gibson AA et al., 2015N71).
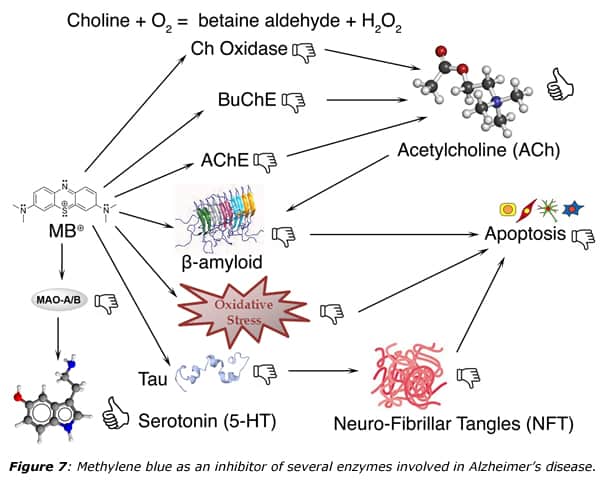
Le bleu de méthylèneN72 ferait preuve de propriétés intéressantes dans la lutte contre des maladies neurodégénératives, d’après un article traitant de son rôle présumément protecteur de l’infection CoVID-19 (Henry M et al., 2020N73). La figure ci-dessous décrit son action possible sur les principales enzymes impliquées dans la maladie d’Alzheimer. Cet effet a été observé dans des études cliniques.
Dans l’étude Impact des facteurs de mode de vie sain sur le risque de démence d’Alzheimer (Klodian D et al., 2020N74), les chercheurs ont évalué l’impact de cinq choix de vie — alimentation saine, activité physique, interdiction de fumer, consommation modérée d’alcool et maintien d’un mode de vie intellectuellement actif — sur la réduction du risque de maladie d’Alzheimer. Pour les sujets ayant adopté 2 ou 3 facteurs de mode de vie saine, le risque est diminué de 39 % comparativement aux sujets ayant adopté uniquement 0 ou 1 facteur de vie saine. Ce risque est abaissé de 59 % lorsque les sujets ont adopté 4 ou 5 facteurs de risque de vie saine. Les même auteurs auteurs préconisent l’adoption d’un régime MIND (Mediterranean-Dash Intervention for Neurodegenerative Delay) inspiré par la diète méditerranéenneN75 et le régime DASHN76.
Ce résultat est corroboré, pour ce qui concerne la démence sénile en général, par l’Étude de Rotterdam (Xiao T et al., 2023N77). Un groupe de 3651 participants ont été suivis sur une quinzaine d’années. Toutes ces personnes, âgées de 72 ± 10 ans en moyenne au départ, ne présentaient aucun symptôme de démence quand leur densité minérale osseuse a été mesurée en plusieurs points du corps, notamment le col du fémur. Au cours des dix années suivant le début de l’étude, le risque de démence était le plus élevé (dans un rapport supérieur à 2) pour les groupes présentant le tertile le plus bas de densité minérale osseuse. Ce résultat est significatif parce qu’on avait tendance à inverser les effets, estimant que la démence entraînait une baisse d’activité physique qui à son tour fragiliserait les os. Or, ici, la fragilité précède le déclin cognitif. Par conséquent, c’est plutôt le style de vie — carences nutritionnelles et manque d’exercice — qu’il faudrait incriminer, autant pour la perte de densité minérale osseuse que pour le déclin cognitif.
La dimension psychologique de cette maladie mériterait une attention accrue. Sur un article de blog (2021N78) un lecteur (le professeur Mario Garrett) commente :
La biologie n’explique pas complètement la démence. Nous ne pouvons ni prédire ni confirmer un diagnostic de démence sur la base de sa biologie. La plupart des adultes possèdent déjà les biomarqueurs. Chez les adultes plus âgés, les biomarqueurs ne sont pas en corrélation avec la maladie, seulement avec les cas graves. Nous ne pouvons pas expliquer le reste. Des études récentes portant sur la prévention — l’étude FINGER est actuellement mise en œuvre dans 25 pays — sont plus prometteuses pour améliorer la maladie. Pourtant, nous ne disposons pas d’une théorie majeure pour expliquer ces résultats sans recourir à la biologie. En comprenant qu’il existe des facteurs, autres que la biologie, médiateurs et modérateurs de la démence, nous avons une vision plus large de la maladie qu’une simple approche binaire. La psychologie joue un rôle essentiel dans cette maladie clinique, par la manière dont la cognition affecte la démence. L’hypothèse est que l’ensemble de la cognition : la perception, l’orientation, la nouveauté, l’attention, l’application des connaissances (praxis), le calcul, le langage, la pensée abstraite et la mémoire affectent et provoquent la démence. Ce n’est pas la démence qui provoque le déclin cognitif, mais le déclin cognitif qui provoque la démence. La psychopathologie de la démence peut initier la démence, la modérer en renforçant ou en retardant la progression de la maladie, ou servir de médiateur à la maladie en agissant comme un processus de confirmation. Le point de basculement exprimé par l’apathie et la dépression annonce le changement de la cognition. La psychopathologie de la démence est importante pour comprendre l’étiologie de la démence, car elle constitue la voie la plus prometteuse pour guérir certaines démences.
Toutes ces affirmations sont documentées. Il est temps d’élargir l’étude à la psychologie.
Ces pistes nouvelles sont encourageantes et peuvent donner lieu à des changements de mode de vie qui, s’ils ne produisent pas les effets miraculeux affichés par des articles triomphalistes, améliorent le bien-être et la santé des patients de maladies neurodégénératives.
⇪ ▷ Liens
🔵 Notes pour la version papier :
- Les identifiants de liens permettent d’atteindre facilement les pages web auxquelles ils font référence.
- Pour visiter « 0bim », entrer dans un navigateur l’adresse « https://leti.lt/0bim ».
- On peut aussi consulter le serveur de liens https://leti.lt/liens et la liste des pages cibles https://leti.lt/liste.
- N1 · l7nc · Maladie neurodégénérative – Wikipedia
- N2 · mvpj · Maladie d’Alzheimer – Wikipedia
- N3 · 44lr · Dave et al. (2016). Reversal of cognitive decline in Alzheimer’s disease
- N4 · 6xbg · New Hope that Alzheimer’s Can Be Prevented—and Even Cured
- N5 · t41d · Médecine fonctionnelle
- N6 · 0mal · Ouvrage “The End of Alzheimer’s : The First Program to Prevent and Reverse Cognitive Decline” – Dle Bredesen
- N7 · 89c0 · Advanced glycation end-product – Wikipedia
- N8 · dlmy · Résistance à l’insuline – Wikipedia
- N9 · 26mx · Mycotoxine – Wikipedia
- N10 · zby3 · Homocystéine – Wikipedia
- N11 · eisg · Borréliose – Wikipedia
- N12 · i8l1 · Hathaway, A et al. (2028). Reversal of Cognitive Decline : 100 Patients. J Alzheimers Dis Parkinsonism 8, 5 : 450.
- N13 · v9vy · Revue prédatrice – Wikipedia
- N14 · ue6k · Hellmuth, J (2020). Can we trust The End of Alzheimer’s ? The Lancet 19, 5 : 389–390.
- N15 · elb0 · Anso, J (2025). Alzheimer : le business de l’espoir. Site Dur À Avaler.
- N16 · k9iu · Bêta-amyloïde – Wikipedia
- N17 · b6m4 · La maladie d’Alzheimer, une maladie contagieuse ?
- N18 · jksc · Identification of PrP sequences essential for the interaction between the PrP polymers and Aβ peptide in a yeast-based assay
- N19 · di1g · Exogenous induction of cerebral beta-amyloidogenesis is governed by agent and host
- N20 · 8qd2 · Distinct synthetic Aβ prion strains producing different amyloid deposits in bigenic mice
- N21 · yker · Evidence for human transmission of amyloid‑β pathology and cerebral amyloid angiopathy
- N22 · 14lr · Ritchie DL et al. (2017). Amyloid‑β accumulation in the CNS in human growth hormone recipients in the UK
- N23 · 3ssw · Frontzek K et al. (2016). Amyloid‑β pathology and cerebral amyloid angiopathy are frequent in iatrogenic Creutzfeldt-Jakob disease after dural grafting
- N24 · zz4j · Cali I et al. (2018). Iatrogenic Creutzfeldt-Jakob disease with Amyloid‑β pathology : an international study
- N25 · u9uw · Dure-mère – Wikipedia
- N26 · gc2y · Jaunmuktane Z et al. (2018). Evidence of amyloid‑β cerebral amyloid angiopathy transmission through neurosurgery
- N27 · ku57 · Morales R (2017). Prion strains in mammals : Different conformations leading to disease
- N28 · vztj · Amyloid‑β peptide protects against microbial infection in mouse and worm models of Alzheimer’s disease
- N29 · 21aj · Could Alzheimer’s Stem From Infections ? It Makes Sense, Experts Say
- N30 · 5cnv · Barrière hémato-encéphalique – Wikipedia
- N31 · bmr3 · Mechanisms By Which the Gut Microbiome Influences Amyloid Deposition and Neuroinflammation in the APPswe/ PS1DE9 Mouse Model of Amyloid Beta Amyloidosis
- N32 · 6ve6 · Microbiote intestinal humain – Wikipedia
- N33 · aej5 · Vous suspectiez la FDA laxiste avec les labos ? C’est pire que ce que vous imaginiez…
- N34 · vht1 · Alzheimer’s Disease-Associated β‑amyloid Is Rapidly Seeded by herpesviridae to Protect Against Brain Infection
- N35 · pgrl · Herpès – Wikipedia
- N36 · 4hoe · Herpèsvirus humain type 6 – Wikipedia
- N37 · c2om · Herpèsvirus humain type 7 – Wikipedia
- N38 · jf72 · Chronic oral application of a periodontal pathogen results in brain inflammation, neurodegeneration and amyloid beta production in wild type mice
- N39 · zvc7 · Une bactérie buccale à l’origine de la maladie d’Alzheimer ?
- N40 · b0qm · Oligomère – Wikipedia
- N41 · a4k5 · Stress-induced blood brain barrier disruption : Molecular mechanisms and signaling pathways
- N42 · k6li · A New Hypothesis for Alzheimer’s Disease : The Lipid Invasion Model
- N43 · u8ar · Nootrope – Wikipedia
- N44 · edx9 · A specific amyloid‑β protein assembly in the brain impairs memory
- N45 · sqz6 · Silvain Lesné is a failed scientist
- N46 · bm4m · Détecter la maladie d’Alzheimer dans la rétine
- N47 · 1tar · Comment ce jeu en réalité virtuelle aide au dépistage de la maladie d’Alzheimer
- N48 · n4tl · Midlife systemic inflammatory markers are associated with late-life brain volume
- N49 · vhds · Hippocampe (cerveau) – Wikipedia
- N50 · v738 · Créatine kinase – Wikipedia
- N51 · ea6c · Vitesse de sédimentation – Wikipedia
- N52 · 08wk · Anticholinergique – Wikipedia
- N53 · 5nt7 · Anticholinergic Drug Exposure and the Risk of Dementia
- N54 · ic4l · Choline – Wikipedia
- N55 · yv7a · Acétylcholine – Wikipedia
- N56 · xah4 · Sphingomyéline – Wikipedia
- N57 · o0lb · Pan, Y et al. (2024). Association of Egg Intake With Alzheimer’s Dementia Risk in Older Adults : The Rush Memory and Aging Project. J Nutr 154, 7 : 2236–2243.
- N58 · jxbl · Facteur neurotrophique dérivé du cerveau (BDNF) – Wikipedia
- N59 · 7om1 · 8 Ways To Increase BDNF Levels (Brain-Derived Neurotrophic Factor)
- N60 · zkay · Could Lifetime Lead Exposure Play a Role in Limbic-predominant Age-related TDP-43 Encephalopathy (LATE)?
- N61 · i2ju · Plasma neurofilament light chain in the presenilin 1 E280A autosomal dominant Alzheimer’s disease kindred : a cross-sectional and longitudinal cohort study
- N62 · kc6i · Maladie de Huntington – Wikipedia
- N63 · m3ac · Neurofilament light polypeptide – Wikipedia
- N64 · z5mn · Li, X et al. (2024). Promising outcomes 5 weeks after a surgical cervical shunting procedure to unclog cerebral lymphatic systems in a patient with Alzheimer’s disease : General Psychiatry 37 : e101641.
- N65 · i65s · Triglycéride à chaîne moyenne – Wikipedia
- N66 · 1yq7 · Effects of a medium-chain triglyceride-based ketogenic formula on cognitive function in patients with mild-to-moderate Alzheimer’s disease
- N67 · xaby · Alzheimer’s Disease Is Type 3 Diabetes–Evidence Reviewed
- N68 · 42pq · Corps cétoniques – Wikipedia
- N69 · o1rh · Maladie de Parkinson – Wikipedia
- N70 · ats8 · Sclérose latérale amyotrophique (Maladie de Charcot) – Wikipedia
- N71 · zoyv · Do ketogenic diets really suppress appetite ? A systematic review and meta-analysis
- N72 · 94kg · Bleu de méthylène – Wikipedia
- N73 · vvdt · Henry M et al. (2020). A cohort of cancer patients with no reported cases of SARS-CoV‑2 infection : the possible preventive role of Methylene Blue – Henry M et al. (28 mars)
- N74 · rbs9 · Impact of healthy lifestyle factors on the risk for Alzheimer’s dementia ; findings from two prospective cohort studies
- N75 · 6edf · Régime méditerranéen – Wikipedia
- N76 · 5kxi · Régime DASH – Wikipedia
- N77 · k89c · Association of Bone Mineral Density and Dementia : The Rotterdam Study
- N78 · pp5j · A Revolution Is Underway in Alzheimer’s, and It’s Not All Good
Article créé le 8/11/2017 - modifié le 11/07/2025 à 16h00




 4147
4147

