
Nous avons vu sur la page précédente (Cancer - nouvelles pistes) que l’expérimentation animale avait permis de mettre en évidence des mécanismes gouvernés par le style de vie (nutrition, exercice…) qui peuvent contribuer à ralentir, voire stopper la croissance tumorale.
Que donnent-ils appliqués aux humains ? Peut-on extrapoler les résultats de cette expérimentation pour proposer des soins en complément des traitements conventionnels ?
Nous verrons que cette approche métabolique est en accord avec les données de la science. Elle peut rendre plus efficace le traitement et diminuer ses effets secondaires — sans pour autant s’y substituer. Elle ouvre aussi des pistes pour la recherche d’une hygiène de vie en prévention du cancer et d’autres maladies chroniques.
Il va de soi que les notions abordées sur cette page ne peuvent pas se substituer à un quelconque traitement du cancer. Ce travail documentaire invite plutôt à des lectures approfondies et des discussions plus ouvertes avec le corps médical — dans les limites imposées (en France) par un étouffement institutionnel de la « liberté thérapeutique » (Delépine N, 2022N1). Cet article est loin de couvrir l’éventail des propositions thérapeutiques, même dans le cadre strict de travaux scientifiques. Le suivi de ces propositions n’est pas garanti.
Sommaire
⇪ Jeûne et restriction calorique
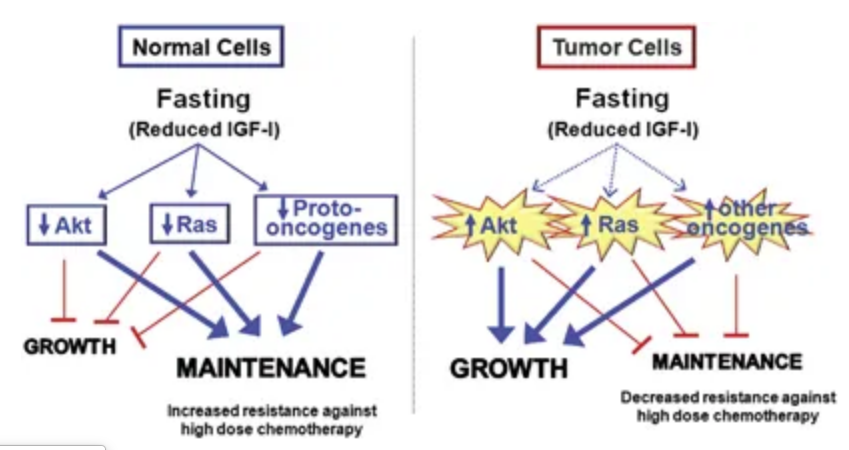
Les travaux de l’équipe de Valter D Longo (voir notamment Lee C et al., 2012N2) ont montré que le jeûne ne guérissait pas le cancer mais qu’il retardait la croissance des tumeurs et augmentait l’efficacité de la chimiothérapie. Il s’agissait au départ de short-term starvation, autrement dit de restriction calorique d’une durée n’excédant pas 24 heures. Une autre étude (Cheng CW et al., 2014N3) a montré qu’un jeûne prolongé (3 jours) pourrait aussi entraîner un renouvellement de cellules souches qui agirait contre l’immunosuppressionN4 induite par la chimiothérapie.
Source : Lee C & VD Longo (2011N5)
Dans un autre article de la même équipe (Brandhorst S et al., 2013N6), il est confirmé par l’expérimentation animale qu’une courte restriction calorique protègerait les cellules saines contre les effets de la chimiothérapie tout en y sensibilisant les cellules cancéreuses, grâce à la diminution du facteur de croissance ressemblant à l’insuline (IGF‑1N7). L’IGF‑1 a par ailleurs pour effet de favoriser la croissance des tumeurs en accélérant leur prolifération et en inhibant le « suicide » (apoptoseN8) des cellules endommagées.
Une lecture plus détaillée des publications et des effets annoncés conduit toutefois à une conclusion moins spectaculaire. En commentaire de l’étude d’Irène Caffa et al. (2020N9) — même équipe — Jérémy Anso écrit (2024N10) :
Conséquence inespérée de son traitement, il a pu inverser la résistance aux chimiothérapies de certaines lignées tumorales. Ce résultat est plutôt exceptionnel, car la résistance des tumeurs à certains produits dégrade fortement les chances de survie. […]
La pratique isolée de cette forme très particulière de restriction calorique, vouée quelque part à entraîner une cétose de l’organisme, n’a pas permis de contrôler l’évolution des tumeurs [chez des souris atteintes de cancer du sein]. Si l’évolution était dangereuse, elle n’était pas si pire qu’une évolution libre dans les groupes témoins. […]
Avec nos connaissances actuelles, il semble plutôt déraisonnable de proposer un jeûne (intermittent ou non) chez une personne à risque de cachexie (perte de poids trop importante pour la corriger seul) avec des conséquences graves pour l’évolution d’un cancer.
Dans l’autre cas, nous n’avons que des hypothèses : solides chez la souris, prometteuses chez le primate et encourageantes chez l’homme. Dans l’attente de données cliniques plus nombreuses et fiables chez l’homme, la pratique du jeûne va rester une décision personnelle avec toutes les limites et avertissements précisés dans cette enquête.
Chez les humains, l’effet sur la glycémieN11 et l’IGF‑1N7 d’une longue restriction calorique (régime alimentaire hypocalorique) n’est vérifié que si elle est pratiquée en association avec une restriction en protéines. Lee et Longo (2011N5) soulignent qu’une restriction calorique de 20 à 40 % pratiquée par des humains sur le long terme (dietary restriction) ne produit des effets (sur certains cancers) qu’après plusieurs mois ou années, en induisant des modifications beaucoup plus modestes au niveau du glucose et de l’IGF‑1. Elle retarde plutôt qu’elle empêche la croissance des tumeurs (Shelton M et al., 2010N12). Elle n’est donc pas une bonne stratégie préventive ni curative pour les patients du cancer, car elle entraîne une perte de poids chez des patients qui y sont sensibles, ou chez ceux qui autrement n’auraient pas perdu ni pris de poids (Lee C et Longo V, 2011N5).
Les auteurs concluent :
Dans la mesure où le cancer dépend de certains nutriments, il existe un grand potentiel de combinaison d’interventions alimentaires et de chimiothérapies ou autres traitements non-toxiques contre le cancer pour l’amélioration du traitement du cancer. En outre, comme indiqué dans cette étude, l’exploration des cibles de médicaments basés sur l’IGF‑1 ou des systèmes qui lui sont liés peut mettre en évidence des régimes simulant le jeûne qui produisent la résistance différentielle au stress (DSR). Des interventions pouvant fournir une protection différentielle entre cellules hôtes et cancéreuses dans une gamme de 1000 fois la protection différentielle observée dans la cellule de levure selon qu’elle manque d’un oncogène analogue ou qu’elle l’exprime, pourraient avoir pour effet un changement de paradigme dans le traitement du cancer.
La pratique du jeûne fractionné (restriction calorique tous les 2 ou 3 jours) est recommandée à titre préventif du cancer. Son effet en association avec une chimiothérapie n’a pas encore été mesuré (Lee C et Longo V, 2011N5). Par contre, le cancer est partout mentionné comme une contre-indication à la pratique du jeûne thérapeutique (suppression de nourriture solide pendant plusieurs jours).
Le jeûne fractionné, la restriction calorique et les régimes simulant le jeûne sont décrits dans mon article Jeûne et restriction calorique.
⇪ Diète cétogène
Source : N13
Dans la même ligne de recherche, un protocole de diète cétogèneN14 proposé par Thomas Seyfried a prouvé sa capacité (sur un modèle animal) à ralentir la progression du cancer, en synergie avec les traitements existants dont il atténue les effets secondaires — voir mon article Diète cétogène, expérience. Il ne s’agit pas uniquement d’un régime mais aussi de restriction calorique. L’expérimentation animale utilisant des diètes cétogènes associées à de la restriction calorique dans le traitement du cancer est étudiée par plusieurs équipes, par exemple Laura M Shelton M et collègues (2010N12).
L’anecdote à l’origine de cette découverte et de l’engagement de Seyfried en cancérologie, au début des années 2000, mérite d’être rapportée (Christofferson T, 2014N15, p. 170–171) :
Une start-up anglaise avait découvert un composé unique : une molécule qui inhibe la formation de certains gangliosides [N16]. La compagnie a été ravie de la perspective que ce médicament puisse être utilisé pour le traitement de maladies du stockage des lipides, et il a envoyé des échantillons pour les tests. Seyfried a obtenu d’un laboratoire différent un échantillon du médicament et il voulait voir comment cela pourrait influer sur le développement du cerveau. En inhibant la production de ganglioside dans des embryons en développement, le médicament pourrait marquer la manière dont les gangliosides affectent le développement du cerveau, ce qui donnerait un aperçu de leur fonctionnalité. Seyfried et ses étudiants ont commencé à bricoler avec le médicament. Ils l’ont administré à des souris avec des tumeurs, plus par curiosité ludique que pour la recherche scientifique. À leur grande surprise, le médicament a semblé ralentir la croissance des tumeurs en comparaison avec les souris témoins.
« Nous avons appelé la compagnie et leur avons dit qu’il semblait que leur médicament pourrait agir sur le cancer — ils étaient ravis », déclare Seyfried. Pour une start-up, un médicament actif contre le cancer a plus de potentiel que celui qui serait actif contre les maladies du stockage des lipides, et la perspective de marché est passée de petite à immense. Enthousiasmée par le potentiel du médicament, la compagnie a remis à Seyfried un chèque de 200 000 dollars pour complément d’enquête. Son laboratoire s’est mis au travail. Tout de suite, ils ont remarqué que les souris ayant reçu le médicament perdaient du poids. Il a demandé à ses élèves d’ajuster le régime alimentaire des souris témoins, de sorte qu’elles perdent autant de poids que les souris ayant reçu le médicament. À la surprise générale, les tumeurs ont aussi ralenti dans les souris témoins. Le médicament avait tout simplement pour effet de faire perdre leur appétit aux souris, imitant en cela la restriction calorique. Seyfried dit : « J’ai dû rappeler la compagnie pour leur dire que leur médicament ne fonctionnait pas. Bien entendu, ils ont repris leurs billes — pourquoi financer ce genre de chose si l’on peut obtenir le même effet en mangeant moins de nourriture ? »
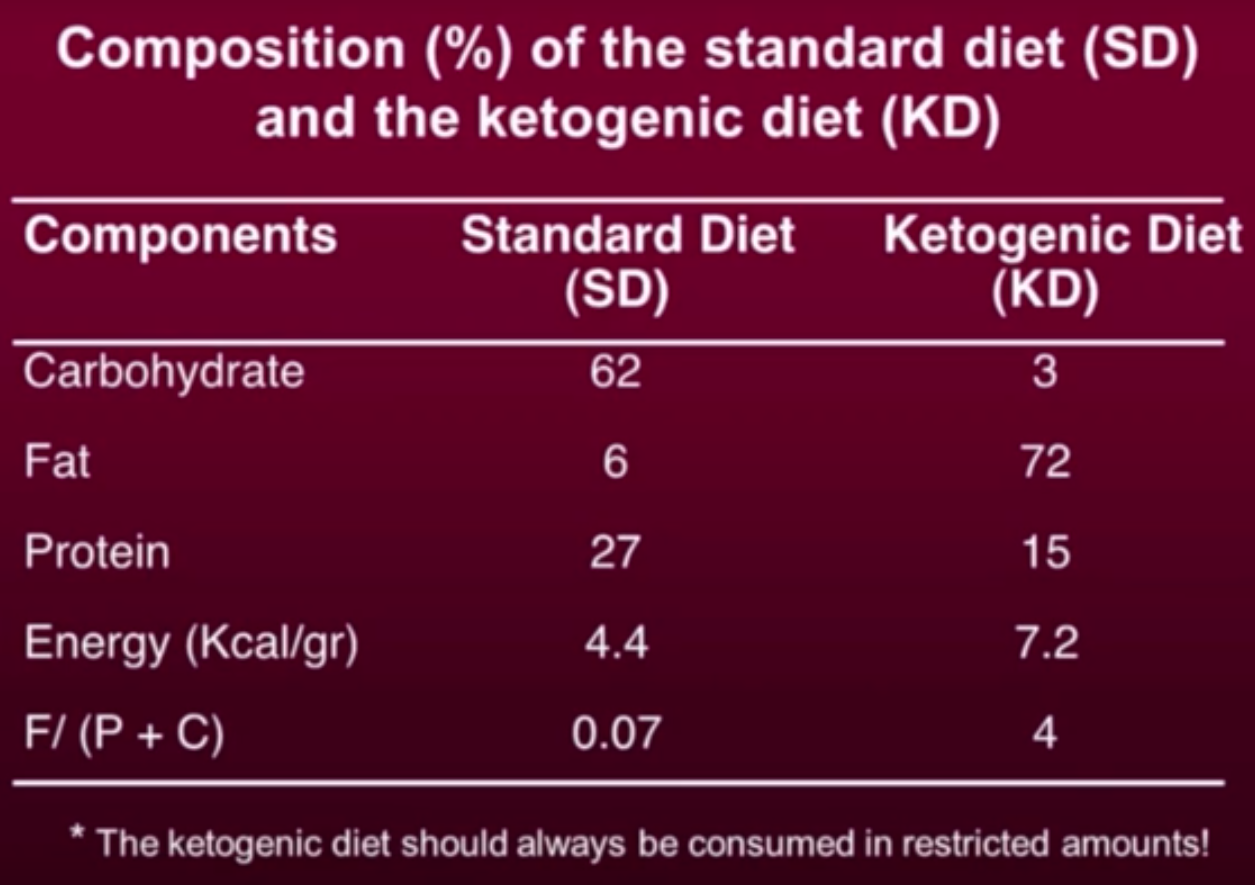
La diète cétogène est un régime alimentaire à très faible teneur en glucides, par exemple 88 % de gras, 10 % de protéines et 2 % de glucides en pourcentages d’apport calorique pour le traitement de l’épilepsie — voir mon article Diète cétogène - expérience. On lit sur de nombreux sites qu’elle contribuerait à « priver de glucose » les cellules cancéreuses, leur principale source d’énergie, mais cette affirmation est fantaisiste : quel que soit le régime alimentaire, l’organisme maintient sa glycémieN11 aussi constante que possible, au besoin par le truchement de la néoglucogenèseN17..
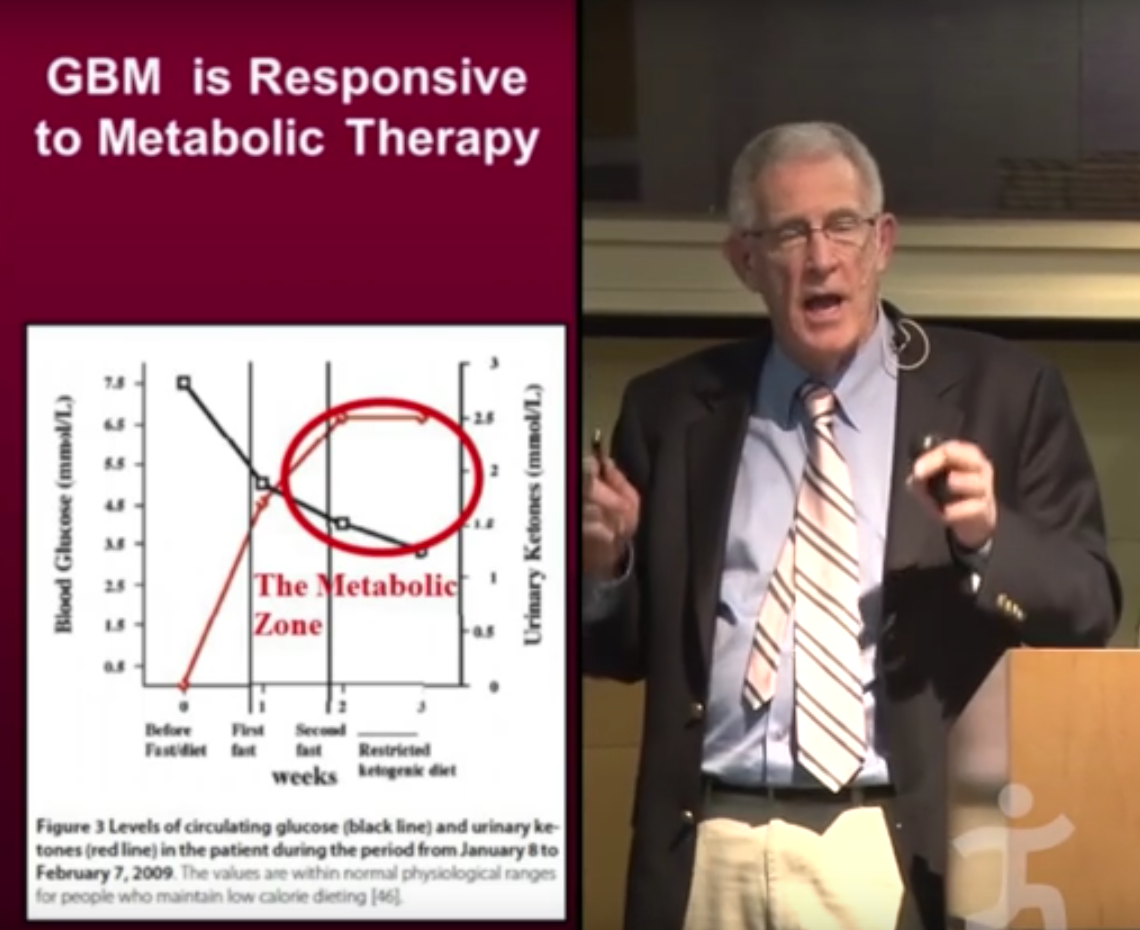
Une explication plus acceptable de l’effet présumé de la diète cétogène est qu’elle obligerait les mitochondriesN18 à fabriquer de l’énergie (sous forme d’ATPN19) en métabolisant des graisses. Cet état métabolique est caractérisé par la synthèse de corps cétoniquesN20 par le foie et leur utilisation comme source d’énergie, à la place du glucose, par les principaux organes, notamment le système nerveux central (WikipediaN21). Autrement dit, c’est le supplément de graisses, plus que la restriction des glucides, qui rendrait effective la diète cétogène. Le moyen le plus sûr de vérifier qu’on est dans une zone de contrôle de la maladie consiste à mesurer le rapport entre les taux sanguins de sucre et de cétones : plus il est faible plus le régime est efficace (Seyfried T, 2014N22).
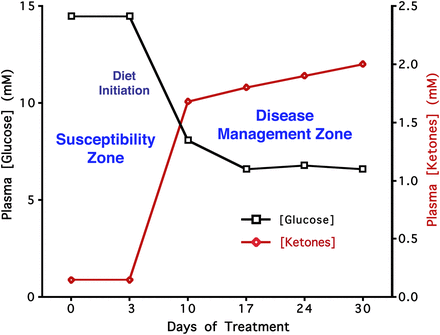
Par exemple, une personne diagnostiquée d’un cancer du sein il y a 12 ans, qui pratique depuis 2 ans une diète cétogène sévère (75–80 % de lipides, 2 % de glucides et 13–18 % de protéines) mesure une glycémie au lever de 0.70 à 0.75 g/l (soit 3.8 à 5 mmol/l) proche de la borne inférieure de la valeur « normale » (0.74 – 1.06 g/l). Sa cétonémieN23 est par contre de 1.2 à 1.5 mmol/l, ce qui est élevé tout en restant inférieur à 3 mmol/l. Ces données la situent dans la zone de “disease management” (voir figure ci-contre) qui correspond à un effet bénéfique de la diète cétogène. Les métastases (rachis, foie, poumon) de cette patiente sont stabilisées, sans traitement conventionnel, et son cancer du sein stade IV n’évolue plus.
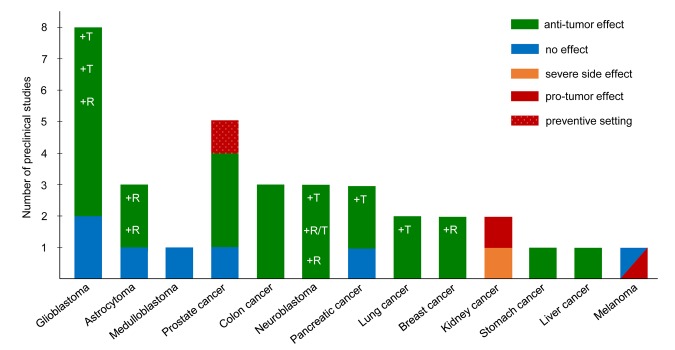
L’équipe de Daniela D Weber et al. (2018N24) a recensé les essais (en expérimentation animale) de diète cétogène pour un traitement direct ou complémentaire du cancer, associée ou non à de la restriction calorique. Les résultats — voir figure ci-dessus — montrent une grande variabilité des effets. La couleur verte marque un effet de régression des tumeurs, mais le rouge un effet négatif. Les auteurs commentent :
Pris ensemble, les résultats des études précliniques, bien que parfois contradictoires, tendent à soutenir un effet anti-tumoral plutôt qu’un effet pro-tumoral de la diète cétogène pour la plupart des cancers solides. Cependant, même si les effets pro-tumoraux sont rares, ils ne peuvent pas être exclus en soi. Plus important encore, les preuves précliniques disponibles impliquent que la faisabilité d’une diète cétogène comme traitement adjuvant du cancer dépend fortement du type de tumeur et de ses altérations génétiques.
On note sur la figure un effet potentiellement négatif de la diète cétogène sur des cancers du rein et des mélanomes, mais l’observation ne porte que sur deux études dans le premier cas et une seule dans le second. D’autre part, il s’agissait d’expérimentation sur des souris. Les variations de glycémie induites par le régime alimentaire étant plus élevées chez l’humain que chez la souris, la diète cétogène pourrait être plus efficace (Seyfried T, 2014N22).
Les études précliniques analysées par Daniela D Weber et al. (2018N24) permettent uniquement de conclure à la diversité des réponses de divers cancers à la diète cétogène — ce qui est vrai des traitements en général, qu’ils soient conventionnels ou métaboliques. À l’appui de cette remarque, Rainer J Klement et al. (2020N25) ont collecté les études publiées dans PubMed en lançant une requête sur les mots-clés ketogenic ET (cancer OU glioblastoma), puis les références citées dans les articles significatifs. Au total, seulement 13 études répondaient aux critères de sélection (N25 pages 3, 7, 8) :
Les douze articles inclus portaient sur 13 études individuelles. Parmi celles-ci, neuf (69 %) étaient prospectives et six (46 %) avaient un groupe témoin, mais seulement deux d’entre elles avaient été randomisées. La majorité des études portaient sur les cancers de mauvais pronostic : les gliomes de haut grade et les cancers pancréatiques et métastasés. […]
Ce qui est remarquable, c’est que seulement deux de ces études avaient un protocole d’étude publié a priori. […]
La majorité des études souffraient de différentes sources de biais : petites tailles d’échantillon (9 études avaient ≤ 10 patients dans le groupe cétogène pour une population de patients donnée), absence de groupe témoin ou manque de randomisation donnant lieu à des biais d’auto-sélection, d’allocation et de performance.
Ils ont conclu : « Des preuves d’effets bénéfiques des diètes cétogènes pendant le traitement du cancer s’accumulent, mais davantage d’études de haute qualité sont nécessaires pour en évaluer le grade global. »
Il existe des témoignages de personnes atteintes de cancers à un stade avancé qui ont réussi à stopper la progression de tumeurs avec la diète cétogène. C’est par exemple le cas de Pablo Kelly, atteint à 25 ans d’une tumeur cérébrale inopérable — un glioblastome multiformeN26 au stade 4 — qu’il a stabilisée en deux ans de pratique cétogène. Kelly commentait en 2016N27 :
C’est du charlatanisme aux yeux de la médecine moderne, mais cela m’aide certainement car je suis toujours en vie. À ma connaissance, je suis la seule personne avec ce type de tumeur cérébrale qui, sans thérapie ni intervention chirurgicale, est encore en vie aujourd’hui. Les médecins m’avaient dit que la diète cétogène ne m’aiderait en aucune façon, j’ai eu cinq scans stables depuis janvier 2015 avec ce régime.
Aux dernières nouvelles (lettre à Thomas Seyfried en 2017) la tumeur était devenue opérable et Kelly a subi l’opération avec succès.
Bien entendu, tous ces exemples sont « anecdotiques », et le biais du survivantN28 peut conduire à des conclusions hâtives.
➡ Rien ne prouve aujourd’hui (2020) que la diète cétogène à elle seule peut faire régresser n’importe quel cancer chez un humain ; l’effet pourrait même être négatif dans certains cas. Associée à de la restriction calorique et de l'exercice de haute intensité, elle peut par contre améliorer les résultats d’un traitement conventionnel ou/et en limiter les effets indésirables.
Un traitement métabolique du cancer basé sur la diète cétogèneN14 et de faibles doses de chimiothérapie est proposé dans la clinique du Dr Abdul Kadir SlocumN29 en Turquie, mais rien de convaincant n’a été publié à ma connaissance. En France, des spécialistes de nutrition ont commencé à guider des patients cancéreux sur la voie d’un régime cétogène en complément du traitement conventionnel — exemple : Walkowicz (2019N30). Les meilleures réponses seraient celles de tumeurs cérébrales et pancréatiques.
Je conseille vivement aux personnes qui envisagent une diète cétogène pour soigner un cancer, de bénéficier de l’expérience et de la réflexion de Taty Lauwers pour déterminer, sans a priori, les choix nutritionnels qui leur conviendront le mieux :
Un dossier détaillé est en cours de construction sur le site de Taty Lauwers (suivre ce lien).
Thomas Seyfried est accusé de charlatanisme sur les sites « quack couac » qui font commerce de la dénonciation de prétendues fraudes scientifiques à partir d’une lecture approximative des publications. Une critique nuancée, reprenant les points positifs des travaux de Seyfried tout en regrettant la prématurité de ses conclusions, a été publiée sur le site Science-Based Medicine (Gorski D, 2014N32) avec des commentaires intéressants.
N’ayant pas pu me procurer son livre (Seyfried, 2012N33), je cède la parole à Michael O’Neill (2013aN34) pour un résumé compréhensible de sa proposition d’une diète cétogène pendant le traitement du cancer :
Je déteste utiliser le terme « guérison », donc je ne le ferai pas. Il y a beaucoup trop de gens qui font la promotion de [régimes à] faible teneur en glucides comme panacée pour tout ce qui vous indispose, et je voudrais dissuader quiconque que cela va guérir le cancer lui-même. Il s’agit d’un outil qui devrait être utilisé dans le contexte plus général du traitement.
Seyfried est clair à ce sujet : « … nous ne pensons pas que [la diète cétogène N14 restreinte] utilisée comme une thérapie singulière, permettra la résolution complète de la maladie pour la plupart des patients » (p. 364). En fait, il dit de sa recherche sur des souris que « la [diète cétogène] n’avait aucune efficacité thérapeutique contre la croissance tumorale lorsqu’elle était consommée […] sans restriction de quantités. » (p. 295)
L’expression clé étant « sans restriction », Seyfried est confiant, par contre, qu’une diète cétogèneN14 avec restriction calorique peut trouver sa place dans le traitement du cancer. Son protocole est décrit en plusieurs phases :
Phase 1 : initiation – Les patients entreprennent une diète cétogène et font régulièrement mesurer les taux de glycémieN11 et de cétonesN35 pour vérifier qu’ils sont dans des intervalles thérapeutiques. « Des taux de glycémie compris entre 3,0 et 3,5 mM (55 à 65 mg/dl) et de β‑hydroxybutyrate [N36] compris entre 4 et 7 mM devraient être efficaces pour réduire la croissance tumorale chez la plupart des patients. » (p. 356)
Par ailleurs, la diète cétogèneN14 à laquelle il fait référence n’est peut-être pas celle que vous utilisez. Il s’agit d’un régime restreint en énergie, celui où la consommation calorique totale est régie par les effets que les choix alimentaires et l’apport énergétique ont sur les lectures de taux sanguins de cétonesN35 et de glycémieN11. En d’autres termes, il n’y a pas une limite calorique spécifiquement, universellement applicable pour tout le monde. Au lieu de cela, mesurer et ajuster si nécessaire.
Source : N37
Phase 2 : chirurgie – Après avoir passé un certain temps (plusieurs semaines) au maintien des intervalles de cétonesN35 et de glucose recommandés en phase 1, « la réduction de l’apport énergétique et la [diète cétogène] permettront de réduire la vascularisation tumorale [N38] et l’inflammation, et vont délimiter plus clairement les tissus tumoraux des tissus normaux de leur environnement » (p. 363). C’est le moment opportun pour l’excision de la tumeur.
L’auteur reconnaît que tous les patients ne peuvent pas attendre plusieurs semaines que le régime cétogène réduise l’inflammation et la vascularisation. À l’inverse, « l’urgence de réséquer des tumeurs malignes dès que possible après le diagnostic peut ne pas être dans le meilleur intérêt de tous les patients, et pourrait en fait exacerber la progression de la maladie en induisant de l’inflammation dans le micro-environnement. » (p. 363). Il est clair que la décision d’opérer dépendra des détails et l’état de la maladie au moment du diagnostic.
Phase 3 : entretien – « L’objectif de la stratégie d’entretien est d’augmenter la probabilité de survie pendant au moins 36 mois chez les patients atteints de cancer métastatique avancé. » (p. 364) Cette phase de traitement est conçue pour prolonger la vie en maintenant une pression métabolique sur les cellules cancéreuses.
Seyfried préconise de continuer à suivre une diète cétogèneN14 limitée en énergie, de suivre en continu les niveaux de glucose et de cétonesN35 dans le sérum, et suggère l’utilisation d’un traitement médicamenteux ciblant le glucose et la glutamineN39, du 2‑DG (30–40 mg/kg chaque jour) et du phénylbutyrate [de sodium ?] (15 g/jour). Le 2‑DG (2‑déoxyglucose) est une molécule qui ressemble à celle du glucose mais ne peut pas être plus métabolisée, de sorte qu’elle bloque le mécanisme de fermentation. Le phénylbutyrate permet de diminuer les niveaux de glutamine en circulation. Le glucose et la glutamine sont les deux principales sources d’énergie du métabolisme des cellules cancéreuses (op.cit. p. 364 ; Hensley CT et al. 2013N40).
➡ Un mot d’avertissement : il est impératif que le dosage et le suivi se fassent en consultation avec un médecin. Ce n’est pas du domaine du do-it-yourself car un mauvais dosage de médicaments peut avoir des effets toxiques.
Dans la lettre du Dr Michael Eades du 16 mars 23, un psychiatre d’Harvard explicite pourquoi des études plus approfondies n’ont pas été menées sur des sujets souffrant de troubles cognitifs :
Le docteur Chris Palmer, professeur de psychiatrie à Harvard et grand défenseur du régime cétogène pour les personnes souffrant de troubles mentaux, graves ou non, est interrogé par Andrew Huberman.
Le docteur Palmer a décrit tous les résultats positifs qu’il a observés chez divers patients souffrant d’une multitude de troubles mentaux (…). Il mentionne ensuite le régime cétogène pour améliorer les facultés cognitives et raconte son expérience avec des patients dont la cognition s’était nettement améliorée. Huberman s’interroge sur le manque d’études à ce sujet. La réponse de Palmer est très instructive. La vidéo ci-dessous est branchée sur le minutage ad hoc, où Palmer répond à la question.
Durée : environ une minute, à partir de la seconde 8055 :
(Suite de la lettre, commentaire de Taty Lauwers) :
Je vous révèle le pot aux roses : lorsque chez John Hopkins l’on a recruté, pour ce genre d’études, 1300 sujets, il s’en est trouvé 27 qui voilaient bien commencer dès qu’ils ont appris la teneur du régime ; et seulement 14 qui on tenu la durée de l’étude.
Les a‑t-on forcés à abandonner ? Oui ! Trois fois oui ! C’est leur addiction aux sucres qui les a forcés à abandonner, ce ne sont pas des pressions des lobbyistes de Big Pharma. L’assuétude aux sucres est telle que, même dans des cas graves, des humains victimes de cette maladie préfèrent négliger une solution possible à leur maladie mortelle.
Le docteur Eades avait écrit un billet en 2008 sur son blog “Protein Power”: https://www.proteinpower.com/carbohydrates-are-addictive/
Il mentionnait le cas de patients atteints de cancer qui avaient suivi tous les traitements disponibles, à qui l’on avait dit qu’il n’y avait plus rien à faire pour eux, et à qui l’on avait offert la possibilité de suivre un régime cétogène comme co-traitement de la tumeur. La plupart d’entre eux avaient abandonné parce que les glucides leur manquaient.
L’étude sur laquelle il se basait a été mise à jour, il nous livre la dernière version : Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer : A pilot trial (Schmidt M et al., 2011N41).
⇪ Au-delà de l’effet Warburg
Une page du site de Chris KresserN42 suggère prudemment que la diète cétogène pourrait être une bonne stratégie pour améliorer — sans pour autant le remplacer — le traitement conventionnel d’un cancer. KL Bonsteel, un des commentateurs, écrit :
C’est une simplification excessive de dire que les cellules cancéreuses utilisent en permanence la fermentation anaérobie. Les tumeurs ont des zones hypoxiques et des zones normoxiques (aérobies), avec une relation symbiotique entre les deux. Les cellules cancéreuses hypoxiques tirent leur énergie de la fermentation du glucose et sécrètent du lactate. Les cellules cancéreuses normoxiques préfèrent attirer le lactate comme combustible pour le cycle TCA, épargnant le glucose aux cellules hypoxiques. Les cellules cancéreuses peuvent passer assez rapidement d’un état hypoxique à un état normoxique et peuvent osciller entre les deux. [NCBI, “Tumor cell metabolism : an integral view”, Romero-Garcia S et al., 2011N43]
Les cellules cancéreuses normoxiques ont également la capacité d’utiliser les cétones comme carburant pour le cycle du TCA, en particulier le 3‑hydroxy-butyrate [N36] dans ce que l’on a appelé « l’effet inverse de Warburg ». La capacité des cellules cancéreuses à utiliser les cétones comme carburant peut expliquer pourquoi les diabétiques présentent un risque accru de cancer (par exemple la cétose diabétique). [NCBI, “Ketones and lactate ‘fuel’ tumor growth and metastasis”, Bonuccelli G et al., 2010N44]
Selon Eric Eidelman et al. (2017N45), les cellules cancéreuses de la prostate utilisent des lipides comme carburant, plutôt que du glucose, et échappent donc aussi à l’effet Warburg. Un autre commentateur de cette même page (Richard Feinman) explique que les cellules tumorales augmentent la sensibilité de leurs récepteurs de glucose. Selon lui, l’effet positif de la diète cétogène résiderait plutôt dans la régulation de l’insuline.
Martine Cordier-Bussat et collègues (2018N46) décrivent en détail l’étonnante flexibilité des cellules cancéreuses qui alternent entre un métabolisme glycolytique aérobie (appelé effet Warburg) et un métabolisme oxydatif en fonction de leurs conditions de développement et expliquent :
Par un étrange tour du destin, l’effet Warburg est passé de sa relégation dans l’oubli à une présence ubiquitaire, devenant le paradigme incontournable des articles et des revues traitant du métabolisme tumoral. Cependant, cette focalisation sur la glycolyse aérobie a eu pour conséquence d’occulter un fait solidement établi : les cellules cancéreuses respirent ! L’analyse rigoureuse des caractéristiques bioénergétiques d’une trentaine de lignées tumorales a en effet permis d’établir que seule 20 % de la quantité totale d’ATP [N19] est produite par glycolyse, le reste l’étant en grande partie par l’activité OXPHOS [N47] mitochondriale. Argument supplémentaire, les molécules agissant comme des inhibiteurs de la chaîne respiratoire, dont la metformine [N48], un médicament utilisé dans le traitement du diabète, exercent des effets cytostatiques sur un grand nombre de types tumoraux.
[…]
Il est désormais clair que les cellules malignes ajustent avec une grande flexibilité leurs besoins en biomasse à leur vitesse de croissance, et qu’elles s’accommodent des contraintes de leur micro-environnement en activant un répertoire de programmes métaboliques qui n’est pas limité au mode Warburg. Elles sont en effet capables de coopérer entre elles, en échangeant en continu des substrats énergétiques, en particulier le lactate [N49] et l’alanine [N50]. Une tumeur peut être ainsi assimilée à un écosystème métabolique qui s’est développé en s’adaptant à la pression de sélection exercée par les mécanismes de défense de la cellule transformée et de l’organisme (gènes suppresseurs de tumeur, sénescence réplicative, immunosurveillance, etc.).
On peut comprendre, avec ce qui précède, que la théorie en vogue selon laquelle la diète cétogène aurait pour principal effet de priver de glucose les cellules cancéreuses n’est pas acceptable. D’autres stratégies sont à l’étude pour mettre à profit le fait que ces cellules ne se nourrissent pas exactement comme les cellules saines. L’ouvrage de Jane Mclelland, How to Starve Cancer… without starving yourself (2018N51) offre une panoplie large de stratégies à partir d’une expérience personnelle de guérison.
L’étude de Cyril Corbet et al. (2016N52) confirme que les cellules cancéreuses, dans un milieu fortement acide, utilisent d’autres stratégies pour fabriquer de l’énergie. Estelle B. commente (2016N53) :
Par ailleurs, les résultats indiquent une profonde reprogrammation du métabolisme des acides gras dans les cellules cancéreuses lorsque le milieu devient acide. Les cellules cancéreuses sont en effet capables à la fois d’utiliser les acides gras pour produire de l’énergie nécessaire à leur croissance, mais aussi de former des lipides à partir de glutamine [N39] pour leur prolifération. Les lipides sont essentiels pour la structure et la fonction des membranes cellulaires.
[…]
Il est bien sûr impossible de priver totalement les cellules cancéreuses d’apports lipidiques, car les tissus sains ont besoin de ces ressources. Mais les chercheurs suggèrent de bloquer l’utilisation des lipides par les cellules cancéreuses, en concevant des substances capables d’interférer avec le métabolisme lipidique particulier des cellules cancéreuses.
Sur le traitement du cancer par la metformineN48, voir par exemple Foretz M & Violet B (2014N54).
Confrontés au cancer du sein triple négatif (CSTN), qui résiste à la plupart des traitements, des chercheurs ont découvert (Tang X et al., 2016N55) que les cellules cancéreuses avaient besoin de cystineN56 pour se répandre dans le corps, et devenaient ensuite dépendantes à ce nutriment. Par conséquent, une voie thérapeutique pourrait consister à priver de cystine les cellules cancéreuses.
⇪ Stress post-traumatique : cause ou déclencheur ?

Un ouvrage richement documenté est celui d’Eléonore Djikeussi (2022N57). Hématologue et oncologue, ce médecin a également une expertise en nutrition et micronutrition. Elle expose les éléments qui contredisent la théorie génétique du cancer et lui permettent de conclure que cette maladie est un processus qui se traduit par des anomalies métaboliques, dans lequel intervient un dysfonctionnement de la mitochondrieN18. L’ouvrage présente des cas cliniques et des témoignages de son activité concernant la nutrithérapie anticancéreuse : régimes hypoglucidiques, dont la diète cétogène.
La lecture de ce livre est à mon avis indispensable à toute personne concernée par cette maladie. Seule ombre au tableau : un paragraphe mentionnant Ryke Geerd HamerN58 — incorrectement affublé du prénom de son fils Dirk — en ces termes (2022N57 p. 101) :
Le Dr Dirk Hamer, en son temps, avait produit un travail dans ce domaine. Il avançait que des cancers peuvent résulter d’un choc conflictuel. Il était peut-être en avance sur son époque ? ou venu dans une époque qui commençait à manquer de curiosité et d’ouverture scientifique ? Comme beaucoup de précurseurs, il n’a pas été entendu. Son postulat méritait une exploration. Il résonne avec l’intuition de ceux qui ne sont pas dominés par la mentalité matérialiste occidentale.
L’évocation d’une « mentalité matérialiste occidentale » et d’un « manque d’ouverture scientifique » face à des « précurseurs » qui ne sont « pas entendus » est un marqueur caractéristique d’une pensée New-AgeN59 en contradiction avec la rigueur scientifique du contenu de l’ouvrage. L’erreur sur le prénom suggère que l’auteure n’aurait pris connaissance que par ouï-dire de la « nouvelle médecine germanique » de Ryke Geerd Hamer. En effet, la thèse de ce médecin — par ailleurs antisémite et négationniste du SIDA — était bien plus radicale (Hamer RG, date inconnueN60) :
Tout cancer, toute maladie débute par un DHS, c’est à dire : un choc psychique, conflictuel, dramatique, vécu dans l’isolement. […] Toutes les maladies, même le rhume, l’angine, ont leur DHS . Le DHS, est un choc qui va mettre tout notre organisme en stress, en condition de combat pour trouver la solution, il est donc important et nécessaire pour vivre. Le DHS est la clé qui nous ouvre la porte de sortie de notre conflit biologique.
Les adeptes de cette « nouvelle médecine » prétendent identifier — scanner du cerveau à l’appui — le conflit psychologique qui serait la cause première, et non un déclencheur, de la maladie du patient, et soigner ce patient en traitant uniquement ce traumatisme psychologique. De nombreux malades de cancer ou de SIDA ont abandonné leur traitement en nourrissant ce faux espoir…
La mention de « Dirk » Hamer dans l’ouvrage d’Eléonore Djikeussi m’apparaît comme rien d’autre qu’une maladresse, car elle ne s’aventure pas dans cette « médecine nouvelle ». Des lecteurs (souvent à leur insu) formatés au New-Age seraient néanmoins tentés d’y voir une confirmation de leurs croyances : c’est pourquoi j’ai jugé utile de commenter ces quelques lignes… Du reste, Eléonore Djikeussi se réconcilie sur la même page avec la « mentalité matérialiste ». Elle écrit (2022N57 p. 101–102) :
[…] des études récentes publiées dans le cadre des désordres liés au stress post-traumatique [N61] permettent de montrer que les marqueurs de l’inflammation augmentent après un stress psychologique chronique, en même temps que des modifications structurales et physiologiques de régions cérébrales de la régulation des émotions et du stress, dont l’amygdale, l’hippocampe, le cortex fontal en particulier (Kim TD et al., 2020N62).
➡ D’aucuns trouveront bizarre de faire la publicité d’un ouvrage en citant un court passage sujet à caution ! Mais la critique qui précède nous ramène à un débat important sur la compréhension et la prévention des cancers. Exercer son esprit critique fait partie intégrante de toute démarche scientifique — ce qu’on a eu tendance à ignorer depuis deux ans. Donc je le répète : ce livre (Djikeussi E, 2022N57) est à ce jour le plus clair et le plus utile que j’ai lu au sujet de « l’approche métabolique » du cancer.
⇪ Cétones, controverse
Richard Veech a eu pour directeur de thèse Hans Krebs, élève et biographe d’Otto Warburg. Un de ses articles (Veech RL, 2004N63) donnait un aperçu des bienfaits thérapeutiques de la production de corps cétoniquesN20. Il citait entre autres une étude de P Mukherjee et collègues (2002N64) :
Dans un rapport surprenant sur des souris chez qui on avait déclenché un astrocytomeN65 [tumeur infiltrante des hémisphères cérébraux], un régime cétogène associé à la restriction calorique a entraîné une diminution de 80 % de la masse tumorale et une diminution de la vascularisation de la tumeur signalant une inhibition de l’angiogenèseN66.
Une supplémentation en cétonesN35 — ou en précurseurs de cétones, comme le butane‑1,3‑diol (BDN67) — permet une diminution de la survie des cellules cancéreuses et prolonge la durée de vie de sujets atteints de cancers métastasés. Cet effet a été confirmé par des travaux récents en expérimentation animale (Poff AM et al., 2014N68) : « Les corps cétoniques possèdent de nombreuses caractéristiques qui peuvent nuire à la survie de cellules cancéreuses et leur prolifération. »
Une discussion détaillée de l’intérêt et des limites de la supplémentation de cétones est proposée sur une vidéo (D’Agostino D, 2016N69). Les conclusions sont à examiner avec précaution car nous avons vu que les cellules cancéreuses pouvaient aussi se nourrir de cétones. Par conséquent, il faudrait empêcher les cétones de les atteindre.
Voir à ce sujet la discussion de Laurent Schwartz (vidéoN70 position 24:37) qui suggère que l’inhibition de l’enzyme SCOTN71 pourrait faire barrière à l’utilisation des corps cétoniques par les cellules cancéreuses. Cette proposition est issue d’un article qu’il a cosigné avec le biochimiste Maurice Israël (2020N72) et publié dans le journal (prédateur) Endocrinology, Diabetes and Metabolism Journal aisément confondu avec le sérieux Endocrinology, Diabetes and Metabolism édité par Wiley.
Maurice Israël a présenté son travail en français sur le site Guérir du cancerN73. Il s’appuie sur cette simple hypothèse pour avancer que le régime cétogène serait dangereux pour le traitement métabolique du cancer, malgré la littérature déjà citée qui le contredit… Laurent Schwartz endosse cette opinion tout en admettant des progrès spectaculaires de patients sous régime cétogène (vidéoN70).
Le torchon a brûlé entre Guy Tenenbaum — « le samouraï », fondateur de l’association Survivre au cancerN74 — et Laurent Schwartz au sujet d’un don de 20 000 € destiné au financement d’une étude sur SCOT qui n’a pas été entreprise par sa fondation Guérir du cancerN75. Dans une série de vidéos, dont une publiée le 13 juin 2020N76, Tenenbaum accusait la fondation d’avoir abusé de sa confiance, ainsi que de celle de nombreux donateurs qu’il avait mobilisés, et Schwartz d’avoir détourné à son nom exclusif la découverte du traitement métabolique qu’il préconise (voir ci-dessous). Ces accusations reposaient sur la seule parole de Guy Tenenbaum, mais les échanges de mails publiés à l’appui de ses propos étaient convaincants (voir sa vidéo du 15 juinN77). Fin juillet 2020, la donation a été remboursée.
Une analyse de la controverse pour/contre la diète cétogène et l’effet de l’inhibition de l’enzyme SCOT est proposée par Jérémy Anso qui signale deux problèmes liés à la théorie sous-jacente (2020N78) :
• L’idée d’inhiber l’enzyme SCOT pour freiner la prolifération cancéreuse a déjà été testée par le passé. Et nous allons le voir, les résultats ne sont pas très encourageants.
• La cellule tumorale possède bon nombre d’autres voies métaboliques pour obtenir de l’énergie, rendant l’idée d’un traitement miracle avec SCOT plus qu’improbable et expliquant le point précédent.
Une étude chinoise antérieure citée par Jérémy Anso (Jie Z et al., 2018N79) — dont Maurice Israël n’avait pas pris connaissance — avait montré, sur des souris cancéreuses, que l’inhibition de l’enzyme SCOTN71 n’aurait aucune influence sur l’effet (bénéfique) d’une diète cétogène. Par contre, l’effet serait amélioré en inhibant à la fois les enzymes SCOT et BDH N80.
Malgré cela, Guy Tenenbaum annonçait fin 2021 (Tenenbaum G, 1er décembre 2021N81) que l’étude sur SCOT avait été menée à bien et publierait prochainement son résultat, qu’il annonçait positif : certains cancers seraient donc « nourris » par les corps cétoniques. Ce « résultat » en effet été « publié » dans un article cosigné par Guy Tenenbaum et Maurice Israël, dans une revue prédatrice Japanese Journal of Oncology and Clinical Research dont Jérémy Anso a signalé les pratiques frauduleuses (Anso J, 2022N82). Auparavant, Maurice Israël avait fait publier trois articles quasiment identiques sur les dangers du régime cétogène dans trois différentes revues prédatrices (Anso J, 2020N83).
⇪ Oxygénation hyperbare

circuit fermé (SEFA).
Licence CC-SA par Anthony Appleyard
Ce traitement a été découvert par Dominic D’Agostino, professeur assistant au Collège de médecine, Université du sud de la Floride. En 2007, l’Office de recherche navale l’avait chargé d’étudier les crises provoquées par la toxicité de l’oxygène chez les plongeurs qui utilisent un appareil respiratoire en circuit fermé. Dans ce cadre, il observait au microscope électronique les effets de l’oxygène à forte pression sur divers types de cellules. Ayant remarqué que certaines cellules ne cessaient de bouillonner puis d’exploser, il découvrit qu’il s’agissait de cellules cancéreuses d’un patient atteint de glioblastome multiformeN26.
D’Agostino avait déjà fait l’expérience de la diète cétogèneN14 comme dispositif pour limiter les crises et autres effets liés à la toxicité de l’oxygène chez les plongeurs. Il savait que cette diète protégeait les neurones de diverses agressions. Ses observations l’ont conduit à l’article Cancer as a Metabolic DiseaseN84 de Thomas Seyfried et Laura Shelton (2010), puis à collaborer avec leur équipe pour étudier les effets combinés de la diète cétogène et de l’oxygénothérapie hyperbare (HBO2TN85). Les résultats en expérimentation animale qu’ils ont publiés conjointement (Poff AM et al., 2013N86) ont été encourageants :
La diète cétogène seule diminue significativement la glycémieN11, ralentit la croissance de la tumeur et augmente la durée de survie moyenne de 56,7 % chez les souris atteintes d’un cancer métastatique systémique. Bien que la HBO2T seule n’ait pas d’influence sur la progression du cancer, la combinaison diète cétogène plus HBO2T a entraîné une diminution significative de la glycémie, du taux de croissance de la tumeur, et une augmentation de 77,9 % de la durée moyenne de survie par rapport au groupe de contrôle.
L’intérêt de la combinaison diète cétogèneN14 + oxygénothérapie hyperbareN85 est de pouvoir être utilisée en complément ou en prolongement d’autres traitements, en raison de son absence de toxicité.
Dans une étude récente (Poff AM et al., 2015N87), l’équipe de D’Agostino a étudié plus en détail — toujours en expérimentation animale — l’évolution de la maladie sous l’effet combiné de ces interventions, auxquelles a été ajoutée une supplémentation en cétonesN35.
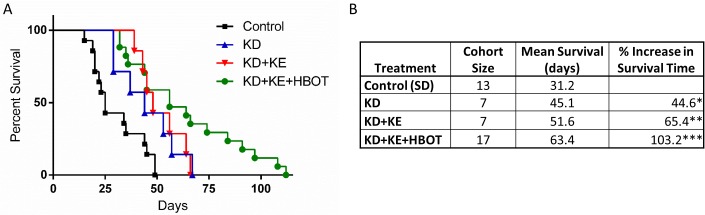
Source : Poff AM et al. (2015N87)
L’oxygénothérapie fait aujourd’hui partie de l’offre de soins de certains médecins qui visent une amélioration du métabolisme cellulaire en complément du traitement du cancer (Meyer A, 2007N88). Toutefois, ce traitement peut avoir des effets indésirables sur la flore intestinale (Mailing L, 2025N89).
⇪ Argent colloïdal
Les vertus thérapeutiques — principalement antibactériennes — de l’argent colloïdal (nano-argent sous la forme de nanoparticules en solution liquideN90) sont fréquemment affichées sur des sites de médecines « alternatives ». Il a été utilisé jusque dans les années 1940 — l’arrivée des antibiotiques — pour soigner des infections bactériennes. Les autorités sanitaires comme la FDA aux USA et la Therapeutic Goods Administration (TGA) en Australie en ont interdit le marketing, faute de preuves scientifiques de son efficacité comme « remède universel », et en raison du danger d’intoxication par absorption d’argent (argyrismeN91).
Il fait toutefois l’objet d’études en cancérologie : Franco-Molina MA et collègues (2010N92) ont mesuré son efficacité pour l’élimination (par apoptoseN8) de cellules cancéreuses en culture (cancer du sein). Voir aussi Aziz N et al. (2019N93). Cette piste reste donc ouverte en complément d’autres traitements.
⇪ Exercice
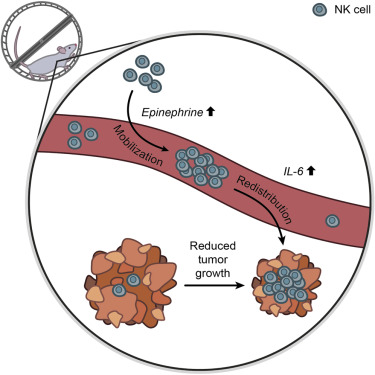
Nous avons vu ci-dessus (« Recadrage des priorités ») que l’exercice de haute intensitéN95 pourrait contribuer à limiter la prolifération des cellules cancéreuses grâce à la production d’agents oxydants (ROSN96), un des activateurs de l’apoptoseN8 des cellules endommagées. Plusieurs études ont montré les effets bénéfiques de l’exercice en complément du traitement des cancers, sans que les mécanismes mis en œuvre aient été clairement élucidés (Betof AS et al., 2013N97).
Une expérience menée par Pedersen L et al. (2016N94) a mesuré un des effets bénéfiques de l’exercice sur la réduction des tumeurs.
Yvette Brazier (2016N98) commente :
Les chercheurs ont la preuve que les lymphocytes NK (N99 Natural Killers, cellules tueuses naturelles) peuvent infiltrer, contrôler et réguler la taille des tumeurs. Mais le processus impliqué et l’effet de l’exercice restaient à élucider. À présent, ils disent qu’un travail de haute intensité pourrait produire un pic d’adrénaline aidant les lymphocytes NK à se déplacer en direction des tumeurs du poumon, du foie ou de la peau.
L’auteur principal Pernille Hojman, de l’Université de Copenhague au Danemark, et ses collègues ont injecté de l’adrénaline à des souris pour simuler l’accroissement de cette hormone pendant l’exercice. Quand ils ont fait cela, ils ont observé que les lymphocytes NK entraient dans la circulation sanguine. Si une tumeur était présente, les lymphocytes NK la repéraient et s’y fixaient.
Ensuite, ils ont utilisé des souris sans lymphocytes NK pour prouver le lien entre l’apparition des NK sur le site de la tumeur et la réduction du cancer. En l’absence de lymphocytes NK, même si les souris faisaient de l’exercice en ayant toute la gamme des autres cellules immunitaires, le cancer croissait normalement. Quand ils bloquaient la fourniture d’adrénaline, la course dans la cage tournante perdait aussi son effet destructeur du cancer.
Le lien entre la mobilisation des lymphocytes NK dépendant de l’adrénaline et l’infiltration tumorale a été identifié comme étant la molécule de signalisation immunitaire, l’IL‑6 [Interleukine 6N100]. On sait que le tissu musculaire libère de l’IL‑6 pendant l’exercice.
Ce qui a surpris les chercheurs est que l’adrénaline appelle spécifiquement des lymphocytes NK sensibles à l’IL‑6, et que les molécules d’IL‑6 aident à guider les cellules immunitaires vers les tumeurs.
Les effets bénéfiques de l’exercice ont été vérifiés par de nombreuses études sur les humains : prévention (Batty D, 2000N101 ; Gonçalves AK et al., 2014N102 ; Nechuta SJ et al., 2015N103), plus longue survie après diagnostic (Holmes MD et al., 2005N104 ; Gerritsen J & Vincent A, 2015N105), diminution de la tumeur du sein et amélioration de la chimiothérapie grâce à l’oxygénation des cellules par l’effet aérobieN106 (Betof AS et al., 2015N97) etc.
Gabriela GF van der Schoot et collègues (2022N107) ont mesuré que la pratique d’exercice — dirigé pendant 12 semaines, puis non-dirigé à domicile pendant les 12 semaines suivantes — compensait partiellement la perte de capacité respiratoire pendant un traitement de chimiothérapie :
Parmi 266 patients atteints principalement d’un cancer du sein, des testicules ou du côlon, qui ont été randomisés pour suivre une intervention physique de 24 semaines pendant ou après la chimiothérapie, la consommation maximale d’oxygène a diminué de manière significative entre le début et la fin de la chimiothérapie dans les deux groupes, mais cette diminution était moins prononcée chez ceux qui ont fait de l’exercice pendant la chimiothérapie.
[…] si l’exercice ne peut être pratiqué pendant la chimiothérapie, un programme après celle-ci peut permettre aux patients de retrouver le même niveau de fonction, mesuré 1 an après la fin de l’intervention.
L’exercice était d’intensité modérée à vigoureuse et comprenait du travail sur un vélo stationnaire, un entraînement en résistance et du badminton.
En insérant une courte séance d’exercice de haute intensitéN95 avant la rupture d’un jeûne de plus de 14 heures, on peut provoquer autant d’autophagieN108 que pendant un jeûne de plusieurs jours, sans affaiblir l’organisme. Cette autophagie assure un recyclage des protéines et des organites non fonctionnels. Ce processus permet par ailleurs de produire plus d’AMPKN109 et de NAD+N110 tout en inhibant le mTOR (cible de la rapamycine chez les mammifèresN111).
Consommer des protéines après l’exercice à jeun réactive le mTOR, arrêtant ainsi l’autophagie et démarrant le processus de reconstruction (Liu GY & Sabatini DM, 2020N112). Ces deux processus doivent être activés de manière cyclique pour optimiser la santé.
Attention : stimuler ce processus [d’autophagie] pourrait être pertinent pour lutter contre des tumeurs précoces, de petites tailles mais contre-productif dans le cas de cancers plus avancés (Anso J, 2023N113). Ces mécanismes ont été étudiés en expérimentation animale. Jérémy Anso ajoute (ibid.) :
Ces observations scientifiques sont donc à l’exact opposé de ce qu’on peut souvent lire sur le net où l’autophagie doit absolument être boostée pour lutter contre un cancer en place et déjà bien avancée. Il n’y a aucune distinction sur la taille ni le type de cancer. […]
D’ailleurs cela peut finalement sembler logique. Pourquoi booster un mécanisme de nettoyage et d’évacuation de déchets pourrait-il avoir un rôle contre le cancer ? Personne ne s’est demandé si l’autophagie sait faire la différence entre une cellule saine et cancéreuse ? Si encore nous parlions de l’augmentation de cellules tueuses de cancer (les fameuses cellules NK, natural killer), ce serait plus logique.
Mais la réalité scientifique, toujours un peu moins glamour, est plus complexe que cela. Les scientifiques sont d’accord pour dire que l’action négative ou positive de l’autophagie dépendra d’un nombre important de paramètres.
C’est pour cette raison que les principaux médicaments explorés dans des essais cliniques pour lutter contre le cancer sont des inhibiteurs de l’autophagie plutôt que des promoteurs. […]
Aujourd’hui nous ne savons pas vraiment à quel moment ni pendant combien de temps il faudrait inhiber ou promouvoir l’autophagie pour améliorer le traitement du cancer. […] Il faudra attendre des essais cliniques rigoureux avec beaucoup de participants pour en avoir le cœur net.
⇪ Traitement métabolique
Il est encourageant de savoir que la recherche sur le cancer a tendance a réhabiliter la théorie d’une maladie causée (ou du moins rendue statistiquement plus probable) par un désordre métabolique. Si cette théorie se confirme, elle remplacera —seulement en partie — la « roulette russe » des mutations génétiques dont on ne pouvait qu’espérer diminuer la probabilité en réduisant l’exposition aux agents carcinogènes.
Cet optimisme doit toutefois être tempéré par la connaissance qu’une fraction non négligeable de cancers sont déclenchés par une attaque virale (Raoult D, 2011N114) — typiquement celui du col de l’utérus lié au papillomavirusN115.
Il semble, par contre, que la découverte de causes liées au métabolisme mitochondrial (Wallace DC, 2012N116) puisse bénéficier à la prévention et au soin de maladies dégénératives ou liées au vieillissement — voir la vidéo de Douglas C Wallace (2014N117). C’est aussi une bonne nouvelle.
L’ouvrage du médecin Paul E Marik, qui a pour titre The role of repurposed drugs and metabolic interventions in treating cancer (Le rôle des thérapies repensées et des interventions métaboliques dans le traitement du cancer) expose en détail de l’hypothèse du cancer comme maladie thérapeutique (Marik PE, 2024N118). Il est disponible gratuitement en PDF après avoir été censuré sur Amazon… « On » reproche en effet au Dr Marik d’avoir promu l’utilisation de l’ivermectine pour le traitement de la CoVID dans le cadre de la Front Line COVID-19 Care Alliance (FLCCCN119) — voir mon article. Pour cette raison, il a été exclu (avec Pierre Kory) de l’American Board of Internal Medicine (ABIM) en 2024 — voir The Arrow #195.
Utilisant son langage à la fois imagé et précis, Eléonore Djikeussi écrit (2022N57 p. 79–80) :
En cas de dépression énergétique prolongée […], pour éviter un funeste déclin, la mitochondrie, Reine de l’Énergie, commande les mécanismes de suppléance qui seront mis en jeu grâce aux modifications des gènes qui contrôlent la production de l’énergie de la cellule.
Lorsque la crise énergétique se prolonge et que la cellule souffre durablement, la mitochondrie a la capacité d’activer la réponse rétrograde qui lui permet, grâce à un système de protéines-messagers, d’envoyer un SOS au noyau.
Elle lui commande d’activer les mécanismes de suppléance énergétique, car c’est lui qui possède la machinerie ancestrale qui permettait à la cellule jadis de produire son énergie, bien avant leurs épousailles définitives, pour le meilleur et pour le pire. Bien que cette union très profitable ait permis à la cellule d’être plus efficiente sur le plan énergétique, celle-ci n’a pas renié son passé. Dans sa grande intelligence, elle a conservé l’ancienne machinerie productrice d’énergie, qu’elle garde silencieuse en temps normal. En sauvetage, elle l’active les jours où les mitochondries sont en difficulté. Car la vie doit continuer, toujours.
L’activité mitochondriale, qui caractérise le taux métabolique, est liée à la fois à des traits de personnalité et aux risques de maladies cardiovasculaires ou de cancers. Georgi Dinkov écrit (2023N120) :
Le séquençage du génome sanguin révèle la présence de très nombreuses molécules d’ADN mitochondrial, et la quantité d’ADN mitochondrial est un indicateur du volume et de la santé des mitochondries. Nous avons donc émis l’hypothèse qu’un faible nombre de copies d’ADN mitochondrial dans le sang serait associé à des personnalités différentes.
La personnalité est mesurée à l’aide d’un questionnaire hautement standardisé qui divise les personnes et mesure différents aspects de la personnalité. Il existe une littérature très abondante qui suggère l’existence de ce trait de personnalité. Le neuroticismeN121 est associé à des résultats de santé défavorables, à un risque plus élevé de maladie cardiovasculaire et à un risque plus élevé de cancer. En fait, nous avons constaté que le neuroticisme était fortement associé à un niveau plus faible du nombre de copies de l’ADN mitochondrial. Il est étonnant que les résultats soient exactement les mêmes dans ces deux populations très, très indépendantes et très, très différentes.
Le traitement métabolique du cancer, que nous avons évoqué en relation aux travaux récents de Seyfried, Longo, D’Agostino et autres en expérimentation animale, reste une approche marginale malgré un nombre appréciable de publications scientifiques sur ce sujet (exemple da Viga Moreira J et al., 2019N122). En France, selon l’Institut national du cancer (INCN123), la chirurgie, la radiothérapie et la chimiothérapie constituent aujourd’hui les grandes catégories de traitement des cancers. Près de 370 000 patients sont traités chaque année par chirurgie, environ 270 000 par chimiothérapie et 170 000 par radiothérapie (sourceN124). Par conséquent, il est inspirant de lire des témoignages divergents, malgré leur caractère anecdotique, surtout en provenance de médecins (exemple : Dr Philippe GentitN125).
Les lecteurs francophones sont interpellés par les travaux du cancérologue Laurent Schwartz (2012N126 ; 2014N127 ; 2016N128) dont le traitement — complémentaire des traitements conventionnels — est supposé améliorer le rendement énergétique de l’activité mitochondriale (Da Veiga Moreira J et al., 2019N122).
S’appuyant sur l’expérience de cultures cellulaires et d’un modèle animal (Schwartz L, Abolhassani M, Israël M et al., 2010N129), il utilise à cet effet une combinaison d’acide lipoïqueN130 et d’hydroxycitrateN131 souvent complétée par de la metformineN48 (Guais A et al., 2012N132). L’usage de l’acide lipoïque remonte à 1977 avec les médecins américains Burt Berkson et Fred C Bartter (1998N133 ; 2016N134). En 2011, Schwartz a déposé l’invention de la combinaison acide lipoïque/hydroxycitrate sans y associer les co-inventeurs (brevet n°20110236506N135)…
D’autres médicaments sont à l’essai, entre autres le dioxyde de chloreN136 qui s’est révélé un substitut efficace de la chimiothérapie sur des cancers agressifs là où la chimiothérapie n’agissait plus. Voir une vidéo de Schwartz annonçant ce résultat et décrivant l’application très simple du traitement en mars 2018 : N137.
Un essai clinique de combinaisons du dioxyde de chlore (DC), de l’acide alpha lipoïque (AAL) et de l’hydroxycitrate (HC) sur des cultures cellulaires dérivées de patients de glioblastomeN26 a été mené en 2018–2019 dans le cadre de l’Institut du cerveau et de la moelle épinièreN138. Dans les conditions expérimentales de cet essai, les effets n’ont pas été démontrés. Les auteurs concluent (2019N139) :
L’objectif de ce projet était d’évaluer l’efficacité de la combinaison de l’AAL – HC avec ou sans le DC. Les données […] nous permettent de conclure que la combinaison AAL – HC n’a pas d’impact sur la prolifération des deux [lignées de glioblastome dérivées de patients] utilisées.
L’ajout de DC à cette combinaison diminue la prolifération cellulaire de 20 à 50 % selon la lignée testée, mais cet effet semble s’expliquer essentiellement par la présence du DC, cet agent seul ayant également diminué la prolifération des cellules de la même façon.
L’AAL seul semble toutefois réduire la prolifération de la [lignée] GBM-PDCL N13-1520 dans l’étude 7 […] où les nouveaux composés ont été testés avec un remplacement de l’ensemble du milieu de culture contenant les composés expérimentaux, tous les jours, deux fois par jour. Cependant, le résultat montré en 4.6 n’est issu que d’une seule expérience, et ces conditions n’ont pas été répliquées dans le cadre du présent contrat. De plus, les conditions de cette expérience n’ont pas permis de conclure sur la deuxième [lignée] GBM-PDCL.
Ce protocole a donc été abandonné et ne donnera pas lieu à d’autres essais sur des animaux ou des humains. Le résultat négatif d’un essai sur des cultures de cellules ne prouve pas que ces traitements seraient inefficaces sur des animaux ou des humains, mais que leurs mécanismes, à supposer qu’ils soient réels, n’ont pas été élucidés. Il n’empêche que, en octobre 2021 — retour à la case départ ? — la fondation Guérir du CancerN75 publie un appel aux dons pour un Projet THEMAN140 en précisant :
Des essais in vitro ont commencé à être menés à Polytechnique Montréal sur la combinaison hydroxycitrate – acide alpha lipoïque – bleu de méthylène. […] Dans un premier temps, il faut donc achever ces premiers essais in vitro afin qu’ils débouchent sur des essais souris. […]
Une étude observationnelle portant sur la pratiques d’autothérapie non médicamenteuse de patients atteints de cancer, organisée autour du traitement métabolique est donc nécessaire. Les résultats de cette étude devraient permettre la mise au point d’autres essais in vitro et in vivo permettant d’enrichir le protocole de soin métabolique.
Une expérimentation avec le bleu de méthylèneN141, moins désagréable que le dioxyde de chlore, a montré son efficacité en expérimentation animale (Yang Shao-Hua et al., 2017N142 ; voir N143 résumé en français) : « … de plus en plus de preuves démontrent que l’amélioration de la phosphorylation oxydative [N47] mitochondriale par transfert alternatif d’électrons mitochondriaux peut offrir une action protectrice contre les maladies neurodégénératives et empêcher la prolifération des cancers. » La dose (sous prescription médicale) serait d’environ 75 mg quatre fois par jour. Il apparaît aussi que le cannabidiolN144 aurait un mode d’action proche du bleu de méthylène en diminuant la captation de glucose et en relançant l’activité mitochondriale (Sun S et al., 2017N145). Une équipe a montré la capacité du bleu de méthylène — en association avec du bleu de toluidineN146 — a réduire la croissance et la viabilité de cellules cancéreuses du pancréas (Biberoglu K et al., 2022N147).
On pourra peut-être envisager le 6‑diazo-5-oxo-L-norleucine (DONN148) qui a donné de bons résultats sur des glioblastomes en expérimentation animale (Mukherjee P et al., 2019N149). Des patients conseillés par Laurent Schwartz font aussi des essais avec l’artémisinineN150.
Parmi les maladies neurodégénératives ciblées par le traitement métabolique, on peut citer la sclérose latérale amyotrophique (Maladie de CharcotN151), la maladie de ParkinsonN152 et la maladie d’AlzheimerN153 (2020N154). Pour la maladie de Charcot (amyotrophic lateral sclerosis ou Lou Gehrig’s disease en anglais) les travaux sur un modèle animal ont montré l’intérêt d’un régime riche en graisses, particulièrement en cholestérol, pour prévenir la maladie ou ralentir son évolution (Paganoni S & Wills A‑M, 2013N155). Chez les humains, une étude prospective sur 891 920 sujetsN156 a mesuré que la mortalité par cette maladie avait été moindre chez des sujets qui consommaient le plus de poulet et de frites, et plus forte chez ceux qui consommaient du riz ou de l’avoine complète ! Ce résultat prêche en faveur d’un régime riche en graisses (de bonne qualité) et pauvre en glucides, éventuellement jusqu’à une diète cétogèneN14.
Laurent Schwartz a mentionné la diète cétogène comme complément de son traitement métabolique, avec toutefois la réserve formulée plus haut : les cellules cancéreuses savent aussi se nourrir de corps cétoniques, si bien qu’une méthode efficace consisterait à les empêcher d’y accéder (vidéoN157 position 23:28). Une patiente cancéreuse avait vu son état se dégrader malgré un traitement métabolique de base (acide lipoïque et hydroxycitrate) associé à une diète cétogène, mais sa rémission a été rapide après avoir complété le traitement par du dioxyde de chlore. Cet exemple est bien entendu anecdotique.
Dès 2010, en expérimentation animale, Schwartz et ses collègues n’étaient pas certains que l’effet Warburg soit la cible correcte de tous les traitements (2010N129 page 1409) :
De notre point de vue, le choix de l’origine de la tumeur n’était pas un élément important car il semble y avoir un accord général actuellement que l’effet Warburg est présent dans la grande majorité des cancers quel que soit le site d’origine et quel que soit le cancérogène responsable […]. Cependant, nous avons sélectionné des lignées cellulaires pour lesquelles la littérature décrivait des preuves de l’effet Warburg.
Certains commentateurs de l’ouvrage grand public de Schwartz (2016N128) sont allés jusqu’à l’accuser d’être un (imposteur ?) « radiothérapeute et non cancérologue »… Il est pourtant facile de vérifier dans PubMedN158 que ce médecin est le co-auteur de plus de 48 publications scientifiques, dont au moins une (Schwartz et al., 2017N159) en collaboration avec TN Seyfried, expert comme nous l’avons vu du traitement métabolique du cancer en expérimentation animale. Aucune publication, à ce jour, n’a fait l’objet de remarques critiques sur le site PubPeerN160. Toutefois, son nom n’apparaît pas dans la base Transparence SantéN161.
Les explications minimales de l’ouvrage Cancer : un traitement simple et non toxique (Schwartz L, 2016N128) sont en accord avec les informations que j’avais précédemment collectées sur le sujet. J’en recommande donc la lecture, pour la clarté de l’exposé, tout en soulignant les mises en garde de l’auteur : (1) le traitement métabolique n’est pas un substitut mais un simple complément des traitements conventionnels, (2) à ce jour il n’a guéri aucun cancer mais seulement prolongé la survie de patients humains en phase terminale, (3) seuls des essais cliniques en phase III pourront prouver l’efficacité du traitement.
On peut lire aussi la synthèse très claire de sa conférence L’équation de la vie, la genèse du cancer (Schwartz L, 2023N162).
Pour un patient directement concerné, le mieux consiste à lire attentivement les ouvrages et les prêter à son médecin traitant, pour qu’il/elle puisse prescrire et surveiller un traitement métabolique, en complément d’un traitement conventionnel, sans négliger les essais du dioxyde de chlore ou du bleu de méthylène.
Des personnes bénéficiant d’un traitement métabolique du cancer sont regroupées dans l’association Cancer et MétabolismeN163 (ACM) fondée par Gilles de La Brière suite à une réussite du traitement : « voir guérir mon épouse de 12 à 14 métastases au cerveau en 10 semaines » (lettre à JD Metzger le 14/6/2020). L’ACM a par la suite financé une étude menée par Schwartz mais soupçonnée de falsification ; devant le refus de ce dernier « de créer un comité scientifique et médical pour encadrer ces recherches » (ibid.), l’ACM a cessé toute relation avec Laurent Schwartz.
D’autres patients ont adhéré à l’association L’Espoir métaboliqueN164. Enfin, une fondation Guérir du cancerN75 a été créée pour financer les travaux de recherche menés par Laurent Schwartz sous l’égide de la Fondation de FranceN165— voir plus haut le Projet THEMAN140. Comme je l’ai signalé elle a été en conflit avec l’association Survivre au cancerN74.
➡ Le petit monde du traitement métabolique est devenu le théâtre d’un combat de coqs auxquels s’accrochent désespérément des patients ayant épuisé les ressources des traitements conventionnels…
Le Dr Schwartz intervenait sur le forum Guérir du cancerN166 récemment supprimé sous le prétexte (peu crédible) de « contributions trop peu nombreuses ». Il a été remplacé par un blog qui ne fait qu’accumuler des témoignages enthousiastes… Tous les forums sur les traitements métaboliques sont à lire avec discernement car ils sont de parfaites illustrations du biais du survivantN28. Jérémy Anso (2020N167) cite un exemple :
Vous trouverez sur la chaîne Cancer Therapy de Guy [Tenenbaum, « le samouraï »] de nombreux témoignages de survivants au cancer qui parleront des méthodes alternatives et naturelles qu’ils ont suivies.
Mais c’est précisément le but de la chaîne. Guy cherche et trouve les personnes qui rentrent dans le cadre de son expérience, de sa thématique. La notoriété de Guy lui permet même de se faire contacter par toutes les personnes qui se sentent concernées et qui remplissent les conditions, implicites ou non.
Il en résulte un très fort biais de sélection. On va ici manifestement sur-représenter des cas de survivants grâce à des thérapies naturelles puisque des personnes connues ou des colloques permettent ce genre de rassemblement.
Guy Tenenbaum partage sur sa chaîne Youtube son expérience personnelle de rémission spectaculaire d’un cancer métastasé contre lequel il a lutté par tous les moyens suggérés par une approche qu’il déclare relever de la médecine « naturelle ». Parfois avec une détermination surhumaine dans de longues périodes de jeûne — bien que bizarrement il se soit filmé, attablé devant une assiette bien garnie, par exemple un poulet au 16e jour de jeûne… L’analyse de son récit diffusée par Jérémy AnsoN168 souligne un grand nombre de contradictions et de faits dissimulés, notamment les traitements conventionnels qu’il a suivis. L’intérêt de tels témoignages ne doit pas faire oublier qu’ils restent anecdotiques et que toute extrapolation pourrait être sans effet ou fatale chez d’autres patients. Les biologistes savent de mieux en mieux expliquer l’extrême diversité des processus en jeu dans chaque cancer, la production de métastases et les mécanismes de défense de l’organisme : il n’existe pas de solution miracle applicable à tous les patients.
Un autre cas de rémission de cancer du foie est analysé en détail de manière critique dans un article (Anso J, 2019N169) :
Le témoignage de Michel est important pour plusieurs raisons. Il démontre que l’on peut, sous certaines conditions, venir à bout d’un cancer du foie, en alliant médecine conventionnelle et alternative. Il est donc tout à fait possible de donner sa confiance à la médecine conventionnelle, et à ses traitements, et faire des changements de son mode de vie salutaires de l’autre côté.
Les « guérisons » (ou plutôt rémissions) spectaculaires, que leurs heureux bénéficiaires mettent en exergue pour justifier le choix de thérapies non conventionnelles, peuvent être suivies de terribles récidives qui font s’effondrer leur modèle explicatif, en lui substituant un autre récit souvent contradictoire avec le précédent. C’est ce qui est arrivé, en 2023, au youtubeur Frédéric Evrard, attribuant à sa rechute une cause génétique qu’il n’avait cessé de réfuter lors de sa rémission par des méthodes « naturelles » (Anso J, 2023N170).
L’émission Tambour battant animée par Antoine Spire et Marie-Christine Weiner (2017N171) présente l’approche métabolique en parallèle avec d’autres avancées récentes en immunothérapie et en cancérologie de l’enfant. Laurent Schwartz intervient dans les trois premières parties. Un entretien entre Joël de RosnayN172 et Laurent SchwartzN173 dans le cadre du forum Changer d’ère – À la conquête des secrets du vivant (2 avril 2019N174) décrit assez clairement sa conception du traitement métabolique et de la prévention du cancer. Il s’est malheureusement égaré par la suite en spéculant sur une vision simpliste qui n’est autre que la généralisation à toutes les maladies métaboliques de sa théorie (non prouvée) sur le cancer.
L’ouvrage La fin des maladies ? Une approche révolutionnaire de la médecine (Les Liens Qui Libèrent, 2019) est exemplaire d’un travail bâclé destiné à un lectorat crédule : paragraphe dupliqué (p. 88–89), pH sanguin, éloge de l’expérience de Luc Montagnier qui aurait réalisé un transport « électromagnétique » de l’ADN via une connexion internet (p. 62–63), explication de la schizophrénie par « le liquide céphalo-rachidien [… qui] ne peut s’écouler normalement dans le liquide céphalo-rachidien » (p. 119), etc. Les perles sont nombreuses, qui permettent de relativiser la rigueur scientifique revendiquée par cet auteur…
Les anglophones peuvent lire sur le site de Laurent Schwartz (octobre 2022N175) son Manifesto for an effective treatment of the diseases où l’auteur se positionne ainsi :
Ce texte est le résultat de longues réflexions et d’expériences menées par de nombreux médecins, chercheurs et patients qui souhaitaient que la tragédie du cancer prenne fin. Nous avons effacé les noms des différents contributeurs, pour nous concentrer sur la découverte d’un traitement efficace du cancer. Pour comprendre le cancer, il fallait s’affranchir des dogmes dépassés et revenir aux lois de la physique, qui sont universelles. Cette évolution vers une véritable science n’a été possible qu’avec l’émergence de nouveaux acteurs dans le domaine de l’oncologie, mathématiciens et physiciens. […]
Le but de ce texte est de partager notre compréhension, de donner de l’espoir et de lever les derniers obstacles. Certaines intuitions expliquées ici doivent encore être étayées par de nouvelles expériences et, surtout, des essais cliniques doivent prouver (ou réfuter) nos hypothèses. Pour le non-scientifique, ce texte peut paraître difficile, car un détour par la physique est nécessaire. Mais l’espoir est justifié car la science est enfin là. Le drame du cancer n’a que trop duré.
L’ouvrage d’Annie Brandt The Metabolic Approach to Cancer (2016N176), une Américaine qui a survécu à un cancer du sein métastasé diagnostiqué en 2001, contient des propositions dans la même ligne de pensée, associées à l’utilisation de chimiothérapies ciblées (Insulin potentiation therapyN177). Brandt est cofondatrice de la Best Answer for Cancer Foundation (BAFCN178) qui regroupe des oncologues praticiens de médecine intégrativeN179 et leurs patients.

Nasha Winters et Jess Higgins Kelley (2017N180) donnent des indications pour évaluer la capacité de réponse de patients au traitement métabolique du cancer — et par extension un pronostic d’efficacité des traitements conventionnels. Leur évaluation est une mesure de la « santé mitochondriale » et peut être conduite à partir d’un bilan sanguin. En voici un aperçu simplifié :
- Le rapport des granulocytes neutrophilesN181 sur les lymphocytes devrait être proche de 2/1 (cité le 30 juin 2019 dans un entretien avec Dr Mercola) ;
- Le taux de lactate déshydrogénase (LDHN182), l’enzyme produisant le lactate, ne devrait pas dépasser 263 U/l (voir articleN46);
- La vitesse de sédimentationN183 (première heure) devrait être inférieure à 10 mm ;
- Le taux de protéine C‑réactiveN184 (mesure ultrasensible) devrait être inférieur à 1 mg/l.
Si toutes ces conditions sont réalisées chez un sujet cancéreux, l’évolution de sa maladie a de fortes chances d’être favorable après le traitement. Les auteures recommandent entre autres la diète cétogène qui permettrait selon elles d’augmenter l’efficacité des traitements conventionnels et de limiter leurs effets secondaires. Leur ouvrage mérite d’être lu en exerçant son esprit critique : vérification des sources.
Un autre ouvrage en vogue chez les lecteurs anglophones est How to Starve Cancer de Kelly Leary (2020N185) — que je n’ai pas encore lu.
Toujours dans le monde anglophone, les observations du Dr Michael Eades, diffusées sur sa lettre The Arrow, ont été résumées en français par Taty Lauwers (2013N186). Eades termine sur cette déclaration : « Si j’avais la malchance de me voir diagnostiquer une tumeur maligne, je peux vous dire avec certitude que j’opterais pour la thérapie métabolique. »
L’approche du cancer comme maladie métabolique pourrait être résumée par ces mots d’Eléonore Djikeussi (2022N57 p. 89–90) :
Le cancer n’est donc ni une tumeur isolée, ni une maladie d’organe. C’est un processus qui touche le corps dans son entier : le tissu cancéreux apparaît comme un processus adaptatif avec des cellules qui prolifèrent à tout prix, car la vie veut vivre, et qui reprogramment apparemment, égocentriquement, l’ensemble de nos systèmes à leur profit avec la participation de nombreuses cellules saines dont les cellules de l’immunité.
C’est une maladie du système dans son ensemble, contrairement à ce qu’on tente de nous faire croire actuellement avec des cancérologies d’organe, spécialisées, gérées par des sur-spécialistes du cancer du sein, de l’ovaire, de la prostate, du poumon, etc., tels qu’on les trouve dans certains grands centres anticancéreux.
Cette citation apparaît à la fin d’un exposé détaillé, mais compréhensible, intitulé Le Cancer, un processus adaptatif pour la survie cellulaire (Djikeussi E, 2022N57 p. 79–90) qu’il serait imprudent de chercher à résumer : je recommande donc vivement la lecture de l’ouvrage de cette oncologue (qui exerce dans la région parisienne).
Les approches qu’on peut classer dans la catégorie « traitement métabolique du cancer » ont en commun une simplicité d’explication qui contribue à leur popularité. Le public privilégie les explications faciles à comprendre, mais est-ce un indice de leur validité ? Les promoteurs de ces théories, malgré leur bagage scientifique, ne se laissent-ils pas entraîner par une vague médiatique qui les rend populaires dans certains milieux « alternatifs » ?
Je reste perplexe, au vu des titres et des contenus de livres qu’ils adressent aux non-initiés, ainsi que de leur proximité avec les bonimenteurs de pseudo-sciencesN187. C’est dans le domaine du traitement du cancer qu’on rencontre le plus souvent les experts Youtube ciblés dans l’article Ma démarche.
⇪ La prévention

L’obésité est un facteur de risque commun à tous les cancers, comme l’a montré une étude prospective menée pendant 16 ans (1982–1998) sur plus de 900 000 adultes américains (Calle EE et al., 2003N188) dont 57 000 sont décédés de cancer. En moyenne, le risque de mourir d’un cancer n’est pas augmenté significativement (sauf si l’on exclut les fumeurs) dans la catégorie « surpoids » — indice de masse corporelle de 25 à 30 kg/m2 — mais au-delà dans la catégorie « obésité » et jusqu’à 52 % pour « l’obésité morbide » (≥ 40 kg/m2). Ces risques sont vraisemblablement sous-estimés du fait que les personnes atteintes de cancer ont tendance à perdre du poids. Les auteurs ont conclu qu’en moyenne (aux USA) l’obésité contribuerait de 14 % au cancer chez les hommes et de 20 % chez les femmes. Cette contribution est bien plus marquée pour certains cancers — un risque multiplié par 2.12 pour le cancer du sein chez des femmes morbidement obèses — alors qu’elle est moins marquée pour les cancers du poumon, du col de l’utérus ou de la prostate.
Une étude rétrospective basée sur le suivi pendant 14 ans d’un million de femmes d’âge moyen 66 ans au nord-ouest de l’Angleterre, a comparé un groupe de patientes avec cholestérol élevé avec celui à faible cholestérol. L’étude statistique a montré que, dans le groupe à haut cholestérol, l’incidence de cancer du sein avait été 0.6 fois celle de celui à faible cholestérol. Le groupe diagnostiqué à haut cholestérol au départ avait aussi une mortalité plus faible que celui à bas cholestérol (13.8 % contre 23.7 %) (Paddock C, 2017N189). Voir mon article : Pourquoi diminuer le cholestérol ?
Une étude suédoise (Heir T et al., 2016N190) correspondant au suivi de 2000 hommes sur 40 années met aussi en évidence une association inverse entre le niveau de cholestérol total et le risque de cancer de la prostate.

L’association entre consommation de tabac et risque de cancer du poumon a été prouvée par de nombreuses études épidémiologiques (Jones NL, 2008N191), mais les mécanismes biochimiques de cette association restent méconnus. Aucune étude n’a prouvé que la nicotine serait cancérigène. La toxicité des produits en contact avec les cellules pulmonaires est plus couramment admise comme explication. Toutefois, fumer est une pratique à risque pour des cancers autres que celui du poumon.
Nogueira ML et al. (2015N192) soulignent que l’inflammation est un risque majeur de plusieurs maladies métaboliques telles que le cancer et la maladie d’Alzheimer. Ces auteurs ont aussi énoncé une équivalence entre inflammation et augmentation de pression. L’accumulation de stress mécanique joue un rôle clé dans le développement de maladies liées au vieillissement, telles que la cardiomyopathie, l’athérosclérose et l’arthrose, mais la pression peut également être un facteur clé de la cancérogenèse (2015N192).
Les facteurs participant à la cancérisation sont décrits dans l’ouvrage d’Eléonore Djikeussi (2022N57 p. 90–110) :
- L’inflammation chroniqueN193 et le stress oxydantN194 (p. 90)
- L’inflammation chronique au cours du syndrome du foie grasN195 associé au syndrome métabolique (p. 93)
- L’inflammation neurogèneN196 (p. 98)
- Les inhibiteurs de la chaîne respiratoire mitochondriale : l’exemple des fongicides… (p. 104)
Une fois que le cancer est diagnostiqué, les études montrent que le traitement médical deviendrait plus efficace — et mieux toléré — par l’adoption de pratiques analogues à celles qui contribuent à sa prévention. S’il est vrai qu’une diète cétogèneN14 avec restriction calorique est plus contraignante qu’un régime faible en glucides (paléoN197, chrono-nutrition etc.), d’autres pratiques sont à la portée de chacun, comme celle de l’exercice de haute intensitéN95.
Signalons, enfin, que des cancers peuvent être déclenchés par la prolifération de certaines bactéries « malfaisantes », entre autres fusobacterium nucleatumN198 qui peut envahir l’organisme si les barrières sont insuffisantes (Galeano Niño JL et al., 2022N199). Cette bactérie anaérobie se développe dans la flore buccale. Détectée sous lumière fluorescente, elle est traitée par des bains de bouche à l’eau oxygénée associés à des compléments nutritionnels spécifiques — voir l’article La bouche, miroir de votre santé.
Jorge Luis Galeano Niño et collègues écrivent (2022N199) :
Grâce à des études fonctionnelles, nous montrons que les cellules cancéreuses infectées par des bactéries envahissent leur milieu environnant sous forme de cellules uniques et recrutent des cellules myéloïdes dans les régions bactériennes. Collectivement, nos données révèlent que la distribution du microbiote dans une tumeur n’est pas aléatoire ; au contraire, elle est hautement organisée en microniches avec des fonctions de cellules immunitaires et épithéliales qui favorisent la progression du cancer.
⇪ Quid des méthodes « alternatives ? »
Ayant longtemps navigué à proximité des médecines « alternatives », j’ai connu (directement ou indirectement) des personnes diagnostiquées cancéreuses qui s’en étaient « sorties » sans avoir recours à un traitement classique — chirurgie, chimio, rayons… Les unes ont modifié radicalement leurs conditions d’existence, d’autres ont fait appel à des thérapies qualifiées de charlatanisme par la médecine orthodoxe. Bien souvent, ces deux démarches étaient combinées. Toutefois, celles qui n’ont pas bénéficié des promesses d’une thérapie « naturelle » ne sont plus là pour en témoigner, pas plus d’ailleurs que celles pour lesquels le traitement conventionnel s’est révélé inefficace. C’est un exemple typique de biais des survivantsN28.
Il faut signaler d’innombrables campagnes frauduleuses sur Internet faisant la promotion de méthodes « naturelles » présentées comme plus efficaces que les traitements médicaux. Ainsi, par exemple, la blogueuse Belle GibsonN200 qui avait fait fortune en recueillant des donations et en vendant des articles sur une méthode supposée avoir guéri chez elle un cancer du cerveau en phase terminale, a fini par avouer qu’elle n’avait jamais eu de cancer ! (Dayey M, 2015N201)
Il est prudent de se rendre compte que la majorité des publications scientifiques frauduleuses en médecine ont trait à des traitements du cancer. Certaines études s’appuient sur des méthodologies apparemment licites, leur seul défaut étant de ne pas être reproductibles. Elles peuvent malgré tout être financées par des organismes officiels, comme les National Institutes of Health aux USA. Exemple : le traitement de cancers par des pratiques psychiques (David S, 2025N202).
Ces exceptions mises à part, vue la diversité des approches de traitement métabolique, il devient moins iconoclaste d’évoquer des pratiques en marge de la médecine scientifique. Toutefois, je ne suis pas habilité à dresser un inventaire des méthodes « alternatives », ceci pour plusieurs raisons :
- Elles sont documentées sur de nombreux sites web et dans les ouvrages de naturopathie (Brandt A, 2016N176).
- Leurs auteurs conditionnent souvent leur réussite à l’abandon de toute intervention médicale conventionnelle. Cette position est éthiquement inacceptable car elle « prend le patient en otage » dans son espoir de survie. L’étude rétrospective de Skyler B et al. (2017N203) sur la survie de patients atteints de cancers non-métastasés (tous curables) du sein, du poumon, de la prostate ou colorectal, ayant fait le choix d’une médecine alternative en remplacement du traitement conventionnel, a montré que ces derniers affichaient en moyenne 2.5 fois plus de décès pendant la période d’observation que ceux qui avaient suivi le traitement.
- Chaque récit n’a qu’une valeur anecdotique : il ne s’agit pas de groupes de personnes soumises à un protocole expérimental — études randomisées contrôléesN204 — permettant de mesurer statistiquement l’efficacité d’une méthode.
- Seules les histoires à succès (success stories) sont publiées. Dans le cas de maladies graves, les patients ayant connu l’échec d’une tentative ne sont souvent plus en mesure de témoigner. Au début des années 2000, j’ai entendu parler d’une femme (médecin) qui aurait « guéri » son cancer de l’utérus en suivant la thérapie de R.G. HamerN58 et publié un livre relatant son expérience « preuves à l’appui ». Un an ou deux plus tard, elle a rechuté. Cette fois, elle s’est fait soigner par chimiothérapie sans pour autant publier un deuxième livre qui aurait corrigé le triomphalisme du précédent…
- Il existe des cas de rémission spontanée (voire de guérison) chez des personnes qui adoptent, par exemple, un régime alimentaire (souvent avec restriction calorique), d’autres qui changent de régime, et d’autres enfin qui renoncent à tout régime et tout traitement. Ce ne sont encore que des informations anecdotiques malgré les espoirs que ces témoignages peuvent susciter. (Consulter les liens sur cette page Wikipedia : N205.)
S’il est légitime de s’interroger sur l’efficacité d’un protocole de traitement, c’est au seul patient qu’il incombe d’exercer son choix dans un dialogue avec les spécialistes, quitte à en consulter plusieurs pour comparer leurs propositions. La théorie métabolique du cancer tend à montrer qu’il n’y aurait pas d’incompatibilité entre un traitement médical correctement ciblé et des pratiques de médecine complémentaire visant à restaurer la santé du métabolisme cellulaire.
⇪ Soins par les plantes
La phytothérapie sur la base de protocoles scientifiques occupe une place marginale dans la palette de traitements complémentaires des traitements conventionnels, malgré des résultats encourageants, voir par exemple l’étude de Trogrlić I et al. (2018N206) sur le traitement du glioblastome multiformeN26.
Si les plantes peuvent augmenter l’efficacité des soins, certaines peuvent aussi interférer dangereusement avec les traitements conventionnels. C’est le cas — entre autres — du soja (non fermenté) et de la saugeN207 pour les cancers hormono-dépendantsN208, du petit houxN209 qui contient des flavonoïdesN210, du mélilotN211 qui est anti-coagulant, du millepertuisN212 et du thé vert qui peuvent interférer avec la chimiothérapie, de la vigne rougeN213 et du ginko biloba N214 pour leurs effets hémorragiques, enfin du poméloN215 qui entrave l’action de certains médicaments.
L’artémisinineN150, une molécule extraite de l’armoise annuelleN216 depuis longtemps connue en Chine et réputée pour son effet anti-paludéen, a fait l’objet d’essais (en combinaison avec du fer) pour le traitement de certains cancers, dont ceux du poumon et du sein (Lai H et al., 2005N217 ; Nakase I et al., 2008N218). L’addition de fer est toutefois remise en question. Aucun essai clinique n’a confirmé son efficacité sur le cancer, alors qu’elle fait déjà l’objet d’une commercialisation intensive à l’initiative de Prof. Peter Seeberger, professeur de chimie à l’Université libre de Berlin et directeur du Max Planck Institute of Colloids and Interfaces à Potsdam (Allemagne). Un essai clinique aurait été annoncé en 2019 au Markey Cancer Center de Lexington, Kentucky (USA). Leonid Schneider raconte en détail — avec sa cruauté habituelle ! — la saga de l’artémisinine (2020N219).
À signaler aussi, le tiglate de tiliganolN220 extrait de graines de Fontainea picrospermaN221 par une équipe de l’Université de Stanford (Wender PA et al., 2022N222), qui produirait une réponse immunitaire ciblée sur les cellules tumorales (Cullen JK et al., 2024N223). Des essais cliniques de phase 1 et 2 sont en cours.
De nombreux travaux frauduleux ont fait l’objet de publications — pour certaines, rétractées suite à des signalements — dans les journaux scientifiques à fort impact. C’est le cas notamment de ceux du professeur Yogeshwer Shukla, expert en cancérologie, protéomiqueN224 et nanotechnologie, qui affirme pouvoir guérir des cancers à l’aide de nanoparticules trempées dans des extraits végétaux (ananas, ail, grenade, thé, mangue, curcuma, raisin…) selon la médecine ayurvédiqueN225. Les mécanismes des falsifications d’images (et donc d’articles) sont détaillés sur le site de For Better Science qui signale les liens entre ce chercheur et d’autres noms célèbres pour leurs rétractions d’articles : Bharat Aggarwal, Sahdeo Prasad (Clyde S, 2019N226)… Tous ces chercheurs opèrent sous la bannière de l’AyurvedaN225 agitée par le chauvinisme exacerbé de l’Inde d’aujourd’hui, portant ombrage aux travaux sur les plantes médicinales menés dans de respectables institutions comme le CSIR-Indian Institute of Chemical BiologyN227 à Kolkata.
Une fois reconnus comme imposteurs, les auteurs continuent à publier dans des journaux « prédateurs » qui font l’impasse sur l’éthique scientifique. Sans surprise, toutes leurs publications (y compris celles qui ont fait l’objet de rétractations) sont citées par les marchands de remèdes « naturels » comme autant de preuves scientifiques de leur efficacité…
(Suite sur la page Cancer - conclusion et références)
➡ Le contenu de cet article ne se substitue pas aux recommandations des professionnels de santé consultés par les lecteurs.
⇪ ▷ Liens
🔵 Notes pour la version papier :
- Les identifiants de liens permettent d’atteindre facilement les pages web auxquelles ils font référence.
- Pour visiter « 0bim », entrer dans un navigateur l’adresse « https://leti.lt/0bim ».
- On peut aussi consulter le serveur de liens https://leti.lt/liens et la liste des pages cibles https://leti.lt/liste.
- N1 · a6ze · Delépine, N (2022). La bureaucratie étouffe le système de santé. Agences sanitaires et liberté de soigner Volet 2. Site du Dr Nicole Delépine.
- N2 · xfsb · Lee, C et al. (2012). Fasting Cycles Retard Growth of Tumors and Sensitize a Range of Cancer Cell Types to Chemotherapy. Sci Transl Med., 4, 124.
- N3 · w5ag · Cheng CW, Adams GB, Perin L, Wei L, Zhou X, Lam BS, Da Sacco S, Mirisola M, Quinn DI, Dorff TB, Kopchick JJ, Longo VD (2014). Prolonged Fasting Reduces IGF‑1/PKA to Promote Hematopoietic-Stem-Cell-Based Regeneration and Reverse Immunosuppression. Cell Stem Cell, 14, 6 : 810–823.
- N4 · fepg · Immunosuppression – Wikipedia
- N5 · e7vy · Lee, C & Longo, V (2011). Fasting vs dietary restriction in cellular protection and cancer treatment : from model organisms to patients. Oncogene. 2011, 30, 30 : 3305–16.
- N6 · dlh7 · Brandhorst, S et al. (2013). Short-term calorie and protein restriction provide partial protection from chemotoxicity but do not delay glioma progression. Exp Gerontol. 2013, 48, 10 : 1120–8.
- N7 · odmk · IGF‑1 – Wikipedia
- N8 · e3yx · Apoptose – Wikipedia
- N9 · l722 · Caffa, I et al. (2020). Fasting-mimicking diet and hormone therapy induce breast cancer regression. Nature 583, 7817 : 620–624.
- N10 · s0tv · Anso, J (2024). Miracle ou Arnaque : la vérité sur le jeûne contre le cancer. Blog Dur à Avaler.
- N11 · iuhf · Glycémie – Wikipedia
- N12 · gsnc · Shelton M et al. (2010). Calorie Restriction as an Anti-Invasive Therapy for Malignant Brain Cancer in the VM Mouse. ASN Neuro May/June 2010, 2, 3.
- N13 · vatn · Seyfried, TN (2015b). Cancer : A Metabolic Disease With Metabolic Solutions. Institute for Human & Machine Cognition (IHMC). Youtube video.
- N14 · f9wb · Diète cétogène – Wikipedia
- N15 · rtjb · Christofferson, T (2014). Tripping Over the Truth : The Return of the Metabolic Theory of Cancer Illuminates a New and Hopeful Path to a Cure. Auto-édition, CreateSpace.
- N16 · rev0 · Ganglioside – Wikipedia
- N17 · aua1 · Néoglucogenèse – Wikipedia
- N18 · alc0 · Mitochondrie – Wikipedia
- N19 · 6qeo · Adénosine triphosphate (ATP) – Wikipedia
- N20 · 42pq · Corps cétoniques – Wikipedia
- N21 · i60z · Cétose – Wikipedia
- N22 · 2icq · Seyfried, TN (2014). Ketone Strong : Emerging evidence for a therapeutic role of ketone bodies in neurological and neurodegenerative diseases. The Journal of Lipid Research, 55, 1815–1817.
- N23 · b73z · Cétonémie – Wikipedia
- N24 · wv5m · Weber, Daniela D et al. (2018). Ketogenic diet in cancer therapy. Aging (Albany NY), 10, 2:164–165. doi:10.18632/aging.101382
- N25 · jnf8 · Klement, RJ et al. (2020). Ketogenic diets in medical oncology : a systematic review with focus on clinical outcomes. Med Oncol 37, 14. doi:10.1007/s12032-020‑1337‑2
- N26 · 6831 · Glioblastome multiforme – Wikipedia
- N27 · sb6t · ‘Quitting carbs has saved my life’: Cancer victim given months to live refuses chemo and claims diet of meat and dairy is why he’s still alive two years later
- N28 · ffga · Biais du survivant – Wikipedia
- N29 · yz9c · Abdul Kadir Slocum M.D.
- N30 · zdok · Ouvrage “Combattre le cancer avec le régime cétogène”
- N31 · n6hr · Vidéo “Les apports de la diététique dans le traitement du cancer” – Taty Lauwers
- N32 · bvmt · Gorski, D (2014). Ketogenic diet does not “beat chemo for almost all cancers” Science-based medicine.
- N33 · r2nj · Seyfried, TN (2012). Cancer as a metabolic disease : On the Origin, Management, and Prevention of Cancer. Wiley.
- N34 · cz64 · O’Neill, Michael (2013). Review of “Cancer as a Metabolic Disease – Thomas Seyfried” – Update on metastasis. June 30. Blog article.
- N35 · ydcj · Cétone – Wikipedia
- N36 · s3af · Acide bêta-hydroxybutyrique – Wikipedia
- N37 · lwiz · SXL05 et vascularisation tumorale
- N38 · 0qtb · Cellule cancéreuse et tissu cancéreux
- N39 · rk8y · Glutamine – Wikipedia
- N40 · xrm8 · Hensley, CT et al. (2013). Glutamine and cancer : cell biology, physiology, and clinical opportunities. J Clin Invest, 123, 9:3678–84. doi:10.1172/JCI69600
- N41 · ny7x · Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer : A pilot trial
- N42 · ai5z · RHR : The Ketogenic Diet and Cancer
- N43 · 7jq0 · Romero-Garcia, S et al. (2011). Tumor cell metabolism – An integral view. Cancer Biol Ther., 12, 11 : 939–948. doi:10.4161/cbt.12.11.18140
- N44 · i51y · Bonuccelli, G et al. (2010). Ketones and lactate “fuel” tumor growth and metastasis. Evidence that epithelial cancer cells use oxidative mitochondrial metabolism. Cell Cycle, 9, 17 : 3506–3514. doi:10.4161/cc.9.17.12731
- N45 · vap5 · Eidelman, E et al. (2017). The Metabolic Phenotype of Prostate Cancer. Front Oncol., 7 : 131.
- N46 · pl29 · Cordier-Bussat, M. et al. (2018). Même l’effet Warburg est oxydable : Coopération métabolique et développement tumoral. Med Sci (Paris), 34, 8–9, août–septembre.
- N47 · o61r · Phosphorylation oxydative – Wikipedia
- N48 · 1ljv · Metformine – Wikipedia
- N49 · qqzu · Acide lactique – Wikipedia
- N50 · pu7k · Alanine – Wikipedia
- N51 · k44i · Mclelland, J (2018). How to Starve Cancer … without starving yourself. Agenor.
- N52 · q0g6 · Acidosis Drives the Reprogramming of Fatty Acid Metabolism in Cancer Cells through Changes in Mitochondrial and Histone Acetylation
- N53 · a5qd · Les cellules cancéreuses assoiffées de graisses
- N54 · g8ib · Foretz M & Violet B (2014). Les nouvelles promesses de la metformine. Med Sci (Paris), 30 : 82–92.
- N55 · 864n · Tang, X et al. (2016). Cystine addiction of triple-negative breast cancer associated with EMT augmented death signaling. Oncogene, November.
- N56 · bdd7 · Cystine – Wikipedia
- N57 · l23i · Djikeussi, E (2022). Cancer : Maladie génétique ou crise énergétique cellulaire ? Le pouvoir de l’alimentation. Gap : Le Souffle d’Or.
- N58 · fxwx · Ryke Geerd Hamer – Wikipedia
- N59 · sres · New Age – Wikipedia
- N60 · w1e9 · Hamer, RG (date inconnue). Introduction à la Germanische Heilkunde®. Blog Germanische Heilkunde.
- N61 · k33b · Trouble de stress post-traumatique – Wikipedia
- N62 · q72y · Kim, TD et al. (2020). Inflammation in Post-Traumatic Stress Disorder (PTSD): A Review of Potential Correlates of PTSD with a Neurological Perspective. Antioxidants, 9, 2 : 107. doi:10.3390/antiox9020107
- N63 · aifx · Veech, Richard L (2004). The therapeutic implications of ketone bodies : the effects of ketone bodies in pathological conditions : ketosis, ketogenic diet, redox states, insulin resistance, and mitochondrial metabolism. Prostaglandins, Leukotrienes and Essential Fatty Acids, 70, 3 : 309–319.
- N64 · qjj7 · Mukherjee, P. et al. (2002). Dietary restriction reduces angiogenesis and growth in an orthotopic mouse brain tumour model. Br. J. Cancer 86, 10 : 1615–1621.
- N65 · f48i · Astrocytome – Wikipedia
- N66 · gvbs · Angiogenèse – Wikipedia
- N67 · 54lc · Butane‑1,3‑diol – Wikipedia
- N68 · mwm3 · Poff AM, Ari C, Arnold P, Seyfried TN, D’Agostino DP (2014). Ketone supplementation decreases tumor cell viability and prolongs survival of mice with metastatic cancer. Int J Cancer. 2014, 135, 7 : 1711–20.
- N69 · v1fr · D’Agostino, D (2016). Modified Atkins Diet, Keto-Adaptation, Ketosis & More. Vidéo Youtube.
- N70 · zh8t · Video “Interview du Docteur Laurent Schwartz, Être Humain #1” — problème régime cétogène
- N71 · d5rp · Succinyl-CoA-3-oxaloacid CoA transferase (SCOT) – Wikipedia
- N72 · ekyl · The metabolic rewiring observed in cancer renders tumor cells dependent of ketone bodies and vulnerable to SCOT inhibition
- N73 · sl7q · Rapport pour SCOT Métabolisme du cancer
- N74 · sf68 · Association “Survivre au cancer”
- N75 · mdx0 · Fondation Guérir du Cancer
- N76 · zhd0 · Vidéo “Le TORCHON brûle : Fondation de France, Laurent Schwartz, Francois et les autres… C’est terminé !”
- N77 · ke3d · Vidéo “Fondation de France, Laurent Schwartz et Francois 15 Juin : Réponses aux emails et les SOLUTIONS !”
- N78 · lk03 · Inhiber l’enzyme SCOT : le “nouveau” traitement miracle contre le cancer ?
- N79 · peph · Jie Z, et al. (2018). Low ketolytic enzyme levels in tumors predict ketogenic diet responses in cancer cell lines in vitro and in vivo. The Journal of Lipid Research, 59 : 625–634. doi:10.1194/jlr.M082040
- N80 · qw52 · BDH1 – Wikipedia
- N81 · e39p · Vidéo “Mon Cancer stade 4 terminal, mes recherches, mes traitements, ma guérison totale 3 ans après ! SCOT”
- N82 · fj69 · Comment j’ai piégé une revue scientifique
- N83 · sy56 · L’incroyable Saga autour du régime cétogène et de l’enzyme SCOT
- N84 · ybt1 · Seyfried, TN & Shelton, LM (2010). Cancer as a Metabolic Disease. Nutr Metab. 2010;7:7
- N85 · yiri · Médecine hyperbare – Wikipedia
- N86 · dx39 · Poff AM, Ari C, Seyfried TN, D’Agostino DP (2013). The ketogenic diet and hyperbaric oxygen therapy prolong survival in mice with systemic metastatic cancer. PLoS One. 2013, 8, 6 : e65522.
- N87 · z7lm · Poff AM, Ward N, Seyfried TN, Arnold P, D’Agostino DP (2015). Non-Toxic Metabolic Management of Metastatic Cancer in VM Mice : Novel Combination of Ketogenic Diet, Ketone Supplementation, and Hyperbaric Oxygen Therapy. PLoS One. 2015, 10, 6 : e0127407.
- N88 · kfrb · Meyer, A (2007). Sauerstoff gegen Krebs – Möglichkeiten einer biologischen Therapie. CO‘MED, Ausgabe 08/07.
- N89 · mr4w · Mailing, L (2025). Hyperbaric oxygen therapy : effects on IBD and the gut microbiome : A promising but nuanced story. Site de Lucy Mailing.
- N90 · 43x7 · Nano-argent – Wikipedia
- N91 · 95l5 · Argyrisme – Wikipedia
- N92 · wnop · Franco-Molina, MA et al. (2010). Antitumor activity of colloidal silver on MCF‑7 human breast cancer cells. J Exp Clin Cancer Res., 29, 1 : 148.
- N93 · m61i · Aziz N et al. (2019). Illuminating the Anticancerous Efficacy of a New Fungal Chassis for Silver Nanoparticle Synthesis. Front Chem., 7 : 65.
- N94 · gvsq · Pedersen, Line et al. (2016). Voluntary Running Suppresses Tumor Growth through Epinephrine- and IL-6-Dependent NK Cell Mobilization and Redistribution. Cell Metabolism, Feb. 2016.
- N95 · w6ci · Entraînement fractionné de haute intensité – HIIT – Wikipedia
- N96 · jdt9 · Dérivé réactif de l’oxygène (ROS) – Wikipedia
- N97 · kpp4 · Betof, Allison S et al. (2013). Effects and potential mechanisms of exercise training on cancer progression : A translational perspective. Brain, Behavior, and Immunity, 30, Supplement, 15 March 2013 : S75–S87.
- N98 · ue83 · Running wheel sets off chain reaction to shrink tumor size
- N99 · 4vmf · Lymphocyte NK – Wikipedia
- N100 · xhkp · Interleukine 6 – Wikipedia
- N101 · h7td · Batty, David (2000). Does physical activity prevent cancer ? BMJ 2000, 321 : 1424.
- N102 · gs8n · Gonçalves, AK et al. (2014). Effects of physical activity on breast cancer prevention : a systematic review. J Phys Act Health. 2014, 11, 2 : 445–54.
- N103 · 5inx · Nechuta, Sarah J et al. (2015). Adolescent Exercise in Association with Mortality from All Causes, Cardiovascular Disease, and Cancer among Middle-Aged and Older Chinese Women. Cancer Epidemiol Biomarkers Prev August 2015 24:1270–1276 ; Published OnlineFirst August 2, 2015. doi:10.1158/1055–9965.EPI-15–0253
- N104 · lu5t · Holmes, Michelle D et al. (2005). Physical Activity and Survival After Breast Cancer Diagnosis. JAMA, 2005, 293 : 20.
- N105 · 3ios · Gerritsen, JKW & Vincent, A JPE (2015). Exercise improves quality of life in patients with cancer : a systematic review and meta-analysis of randomised controlled trials. Br J Sports Med. doi:10.1136/bjsports-2015–094787
- N106 · kpsf · Aérobie – Wikipedia
- N107 · hn3g · van der Schoot, G et al. (2022). Optimal Timing of a Physical Exercise Intervention to Improve Cardiorespiratory Fitness. J Am Coll Cardiol CardioOnc. Nov, 4, 4 : 491–503. doi:10.1016/j.jaccao.2022.07.006
- N108 · 6q20 · Autophagie – Wikipedia
- N109 · t3ka · AMPK – Wikipedia
- N110 · 7kg0 · Nicotinamide adénine dinucléotide (NAD) – Wikipedia
- N111 · o3dy · mTOR – Wikipedia
- N112 · ivb2 · Liu GY & Sabatini DM (2020). mTOR at the nexus of nutrition, growth, ageing and disease
- N113 · pk8m · Autophagie et cancer : une arme à double tranchant
- N114 · zkig · Raoult, D (2011). Ces virus qui donnent le cancer. Tribune Les invités du Point.
- N115 · m44t · Papillomavirus humain – Wikipedia
- N116 · 1ids · Wallace, DC (2012). Mitochondria and cancer. Nature Reviews Cancer 12 : 685–698.
- N117 · i8pq · Wallace, DC (2014). A Mitochondrial Etiology of Metabolic and Degenerative Diseases, Cancer and Aging. Wednesday Afternoon Lectures, NIHvcast. (Vidéo)
- N118 · ex80 · Marik, PE (2024). The role of repurposed drugs and metabolic interventions in treating cancer. Ouvrage en accès libre (PDF).
- N119 · c0tm · Front Line COVID-19 Critical Care Alliance
- N120 · g9o8 · Metabolic rate may determine personality type and disease risk
- N121 · mz5a · Neuroticisme – Wikipedia
- N122 · 9zgb · Da Veiga Moreira J et al. (2019). Metabolic therapies inhibit tumor growth in vivo and in silico. Sci Rep 2019 Feb 28, 9 : 3153. doi:10.1038/s41598-019–39109‑1
- N123 · keuy · Institut National du Cancer
- N124 · b816 · Les traitements du cancer
- N125 · 545d · Témoignage exceptionnel du combat d’un médecin face à son cancer
- N126 · q9tg · Schwartz, L (2012). Cancer : between glycolysis and physical constraint. Springer Science & Business Media.
- N127 · elyk · Schwartz, L et al. (2014). Metabolic treatment of cancer : intermediate results of a prospective case series. Anticancer research, 2014, 34, 2 : 973–980.
- N128 · k7tb · Schwartz, L (2016). Cancer : un traitement simple et non toxique. Thierry Souccar.
- N129 · v4w5 · Schwartz, L et al. (2010). A Combination of Alpha Lipoic Acid and Calcium Hydroxycitrate Is Efficient Against Mouse Cancer Models : Preliminary Results. Oncology Reports, 23, 5 : 1407–1416. doi:10.3892/or_00000778
- N130 · 2mwj · Acide lipoïque – Wikipedia
- N131 · g1k0 · Acide hydroxycitrique – Wikipedia
- N132 · r9ik · Guais, A et al. (2012). Adding a combination of hydroxycitrate and lipoic acid (METABLOC™) to chemotherapy improves effectiveness against tumor development : experimental results and case report. PRECLINICAL STUDIES 30 : 200–211.
- N133 · p54r · Berkson, Burton M (1998). Alpha-Lipoic Acid (Thioctic Acid): My Experience With This Outstanding Therapeutic Agent. The Journal of Orthomolecular Medicine Vol. 13, 1st Quarter 1998 : 44–48.
- N134 · ah3d · Alpha Lipoic Acid Anticancer Agent Burt Berkson MD
- N135 · x4i8 · Pharmaceutical combination containing lipoic acid and hydroxycitric acid as active ingredients. Brevet américain n°20110236506, 2011
- N136 · 580t · Dioxyde de chlore – Wikipedia
- N137 · cjze · Vidéo “TET Conférence Le cancer – Une percée probable Mars 2018” – Laurent Schwartz
- N138 · y55u · Institut du Cerveau et de la Moelle Épinière (ICM) – Wikipedia
- N139 · snzs · Evaluation des effets thérapeutiques du dioxyde de chlore, de l’acide alpha lipoïque et de l’hydroxycitrate dans les lignées de glioblastome dérivées de patients – PDF
- N140 · zl5r · Projet THEMA : Thérapie Mitochondriale Anticancer
- N141 · 94kg · Bleu de méthylène – Wikipedia
- N142 · 9m85 · Yang Shao-Hua et al. (2017). Alternative mitochondrial electron transfer for the treatment of neurodegenerative diseases and cancers : Methylene blue connects the dots. Progress in Neurobiology, 157 : 273–291. doi:10.1016/j.pneurobio.2015.10.005
- N143 · mbvn · “Alternative mitochondrial electron transfer for the treatment of neurodegenerative diseases and cancers : Methylene blue connects the dots” : résumé en français et texte intégral
- N144 · rh62 · Cannabidiol – Wikipedia
- N145 · qfr8 · Cannabidiol attenuates OGD/R‑induced damage by enhancing mitochondrial bioenergetics and modulating glucose metabolism via pentose-phosphate pathway in hippocampal neurons
- N146 · j3v7 · Toluidine – Wikipedia
- N147 · ybd9 · Biberoglu, K et al. (2022). Effects of toluidine blue O and methylene blue on growth and viability of pancreatic cancer cells. Drug Dev Res. 83, 4 : 900–909.
- N148 · c7cf · 6‑Diazo-5-oxo-L-norleucine – Wikipedia
- N149 · 1fm5 · Mukherjee, P et al. (2019). Therapeutic benefit of combining calorie-restricted ketogenic diet and glutamine targeting in late-stage experimental glioblastoma. Communications Biology, vol. 2, article #200.
- N150 · 2xgi · Artémisinine – Wikipedia
- N151 · ats8 · Sclérose latérale amyotrophique (Maladie de Charcot) – Wikipedia
- N152 · o1rh · Maladie de Parkinson – Wikipedia
- N153 · mvpj · Maladie d’Alzheimer – Wikipedia
- N154 · gen8 · Schwartz, Laurent et al. (2020). Cancer and Alzheimer’s disease : intracellular pH scales the metabolic disorders. Biogerontology. doi:10.1007/s10522-020–09888‑6
- N155 · 9urz · Paganoni S & Wills A‑M (2013). High-Fat and Ketogenic Diets in Amyotrophic Lateral Sclerosis
- N156 · l4y3 · Diet and amyotrophic lateral sclerosis
- N157 · ku76 · Vidéo “Interview du Docteur Laurent Schwartz, Être Humain #1” – au sujet de l’alimentation
- N158 · c1th · Publications de Laurent Schwartz
- N159 · g52a · Schwartz, L et al. (2017). Out of Warburg effect : An effective cancer treatment targeting the tumor specific metabolism and dysregulated pH. Semin Cancer Biol., 43 : 134–138.
- N160 · xtm3 · PubPeer, the online Journal club
- N161 · 5wge · Transparence-Santé. Base de données publique des liens d’intérêts avec les acteurs du secteur de la santé (France).
- N162 · l3az · L’équation de la vie, la genèse du cancer
- N163 · wuvj · Association “Cancer et Métabolisme”
- N164 · 7iul · Association L’Espoir métabolique
- N165 · xu5m · Fondation de France
- N166 · 325s · Forum “Guérir du cancer” – Laurent Schwartz
- N167 · wb3f · Cancer : Les témoignages positifs sont-ils fiables ?
- N168 · fq51 · Guy Tenenbaum : la guérison miraculeuse et naturelle qui interroge
- N169 · dtdj · Anso J (2019). Cancer du foie : les enseignements des guérisons plus médiatiques que naturelles
- N170 · bx8z · Anso, J (2023). Survivant au cancer : l’obscure success-story de Frédéric Evrard.
- N171 · y2z0 · Vidéo “TAMBOUR BATTANT” avec Antoine Spire et Marie-Christine Weiner, 2017
- N172 · h4fo · Joël de Rosnay – Wikipedia
- N173 · wiq5 · Laurent Schwartz (oncologue) – Wikipedia
- N174 · gt77 · Vidéo “Forum Changer d’ère – À la conquête des secrets du vivant – Entretien entre Joël de Rosnay et Laurent Schwartz”
- N175 · kb97 · Manifesto for an effective treatment of the diseases
- N176 · 3g5c · Brandt, A (2016). The Healing Platform : Build Your Own Cure ! Best Answer for Cancer Foundation.
- N177 · 0773 · Insulin potentiation therapy – Wikipedia
- N178 · v9ue · Best Answer for Cancer Foundation
- N179 · ig9q · Médecine intégrative – Wikipedia
- N180 · lpx6 · Winters, N & J Higgins Keley (2017). The Metabolic Approach to Cancer : Integrating Deep Nutrition, the Ketogenic Diet, and Nontoxic Bio-Individualized Therapies. Chelsea Green Publishing.
- N181 · xw59 · Granulocytes neutrophiles – Wikipedia
- N182 · 2n1s · Lactate déshydrogénase – Wikipedia
- N183 · ea6c · Vitesse de sédimentation – Wikipedia
- N184 · o3qe · C‑reactive protein – Wikipedia
- N185 · wf2n · Ouvrage “How To Starve Cancer : Complete Guide about Cancer’s History, Treatment, and Prevention” – Kelly Leary
- N186 · vh1p · Les bases métaboliques du traitement du cancer, selon le dr Eades
- N187 · wwss · Pseudoscience – Wikipedia
- N188 · 30kn · Calle, EE et al. (2003). Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. New England Journal of Medicine, 24, 348, 17 : 1625–1638.
- N189 · i8kv · Paddock, C (2017). High cholesterol diagnosis tied to lower breast cancer risk. Medical News Today, on-line journal.
- N190 · lj25 · Heir, T et al. (2016). Cholesterol and prostate cancer risk : a long-term prospective cohort study. BMC Cancer, August, 16 : 643.
- N191 · djzz · Jones, NL (2008). Preuves scientifiques associant l’usage du tabac au cancer du poumon. Document de travail à l’intention du Tribunal d’appel de la sécurité professionnelle et de l’assurance contre les accidents du travail (Ontario). PDF en ligne.
- N192 · ac82 · Nogueira, ML et al. (2015). Mechanical Stress as the Common Denominator between Chronic Inflammation, Cancer, and Alzheimer’s Disease. Front Oncol., 5, 197. doi:10.3389/fonc.2015.00197
- N193 · kqvd · L’inflammation de bas grade ou inflammation systémique
- N194 · 5gjv · Stress oxydant – Wikipedia
- N195 · yhbl · Stéatose hépatique – Wikipedia
- N196 · j03s · Inflammation neurogène – Wikipedia
- N197 · 8wxz · Le régime paléolithique
- N198 · k31o · Fusobacterium – Wikipedia
- N199 · y00q · Galeano Niño, JL et al. (2022). Effect of the intratumoral microbiota on spatial and cellular heterogeneity in cancer. Nature, 16 November. doi:10.1038/s41586-022–05435‑0
- N200 · 8g6x · Belle Gibson – Wikipedia
- N201 · fyb6 · ‘None of it’s true’: wellness blogger Belle Gibson admits she never had cancer
- N202 · rp7m · David, S (2025). The Men Who Stare At Mice. Site “For Better Science”
- N203 · nya0 · Skyler B et al. (2017). Use of Alternative Medicine for Cancer and Its Impact on Survival. Journal of the National Cancer Institute, 110, 1.
- N204 · lcub · Essai randomisé contrôlé – Wikipedia
- N205 · xa2w · Cancer survivor – Wikipedia
- N206 · 2aqq · Trogrlić, I et al. (2018). Treatment of glioblastoma with herbal medicines. World J Surg Oncol, 16.
- N207 · 065r · Sauge – Wikipedia
- N208 · o6sa · Cancer hormono-dépendant
- N209 · q7ft · Ruscus aculeatus (petit houx) – Wikipedia
- N210 · z94f · Flavonoïde – Wikipedia
- N211 · wf3i · Mélilot – Wikipedia
- N212 · hze3 · Millepertuis – Wikipedia
- N213 · 7gz9 · Vigne rouge
- N214 · ildw · Ginkgo biloba – Wikipedia
- N215 · u8of · Pamplemousse et pomélo – Wikipedia
- N216 · hhr4 · Armoise annuelle – Wikipedia
- N217 · r26t · Lai H et al. (2005). Effects of artemisinin-tagged holotransferrin on cancer cells. Life Sci, 76, 11 : 1267–1279.
- N218 · 0xvy · Nakase I et al. (2008). Anticancer properties of artemisinin derivatives and their targeted delivery by transferrin conjugation. Int J Pharm., 354(1–2): 28–33.
- N219 · v3mn · Buy Professor Seeberger’s Artemi-Tea to survive COVID-19 !
- N220 · os55 · Tigilanol tiglate – Wikipedia
- N221 · w5hq · Fontainea picrosperma – Wikipedia
- N222 · p4tq · Wender, PA et al. (2022). Practical synthesis of the therapeutic leads tigilanol tiglate and its analogues. Nat. Chem. 14 : 1421–1426.
- N223 · kpl0 · Cullen, JK et al. (2024). Tigilanol tiglate is an oncolytic small molecule that induces immunogenic cell death and enhances the response of both target and non-injected tumors to immune checkpoint blockade. J Immunother Cancer. 12, 4 : e006602.
- N224 · 61bq · Protéomique – Wikipedia
- N225 · 3ncf · Ayurveda – Wikipedia
- N226 · rgeq · Yogeshwer Shukla’s toxic career of Ayurvedic infusions
- N227 · 64mw · CSIR-Indian Institute of Chemical Biology
Article créé le 20/11/2018 - modifié le 21/06/2025 à 15h21






 16935
16935


4 thoughts on “Cancer – approche métabolique”